9 Minuten
Nach mehr als einem Jahrzehnt laborbasierter Forschung melden Wissenschaftler einen bedeutenden Fortschritt auf dem Weg zu Nieren, die von Empfängern unabhängig von der Blutgruppe akzeptiert werden könnten. Ein multinationales Team hat Spendernieren in eine antigenfreie Form überführt, die — zumindest vorübergehend — bei der Transplantation in ein humanen Modell wie ein Typ‑O‑Organ reagierte. Dieser Schritt könnte helfen, die langen Wartelisten für Nierentransplantationen zu verkürzen und zahlreiche Leben zu retten, indem die Verwendbarkeit von Spenderorganen deutlich erweitert wird.

Die im Labor vorbereitete Niere
Blutgruppenbarrieren als technisches Problem lösen
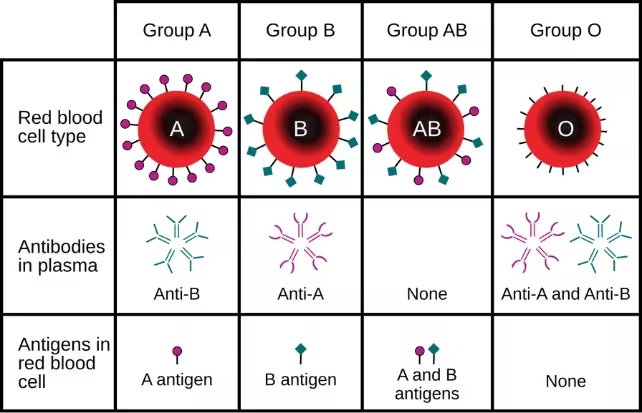
Die Kompatibilität der Blutgruppe ist eines der größten praktischen Hindernisse bei Nierentransplantationen. Das ABO‑Blutgruppensystem legt enge Regeln dafür fest, welcher Empfänger welches Spenderorgan erhalten kann: Empfänger der Blutgruppe O müssen in der Regel auf eine Spenderniere vom Typ O warten, und Nieren vom Typ O sind besonders gefragt, weil sie grundsätzlich bei Empfängern anderer Blutgruppen funktionieren können. Diese Ungleichverteilung verschärft die organbezogene Knappheit und verlängert die Wartezeiten, was zu höherer Morbidität und Mortalität auf den Wartelisten führt.
Um diese Einschränkung zu umgehen, haben Forschende Enzyme adaptiert, die selektiv die Zuckermoleküle entfernen — sogenannte Antigene —, die auf der Oberfläche von Blutzellen und Spendergewebe das Immunsystem signalisieren: „das ist fremd“. Das Forschungsteam setzte diese Enzyme gezielt ein, um die Marker der Blutgruppe A auf einer gespendeten Niere abzutragen und die Niere damit effektiv in eine enzymkonvertierte Typ‑O‑(ECO)‑Organe‑Form zu verwandeln. Diese Art der Antigenentfernung und Enzymkonversion zielt darauf ab, die ABO‑Kompatibilität als lösbares technisches Problem zu behandeln, anstatt ausschließlich auf aufwändige klinische Desensibilisierungsprotokolle angewiesen zu sein.
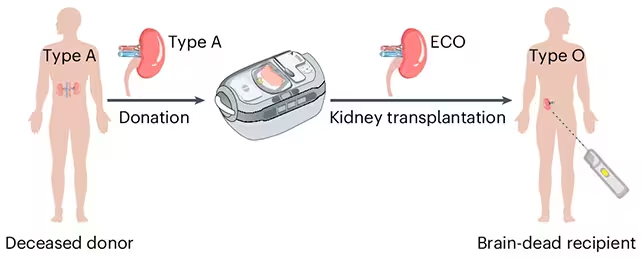
Die Forschenden erzeugten eine enzymkonvertierte Typ‑O‑(ECO)‑Niere, die bereit für die Transplantation war. (Zeng et al., Nat. Biomed. Eng., 2025)
Der Biochemiker Stephen Withers von der University of British Columbia, der im ursprünglichen Bericht zitiert wird, beschreibt die Enzyme wie ein Paar molekularer Scheren: Sie schneiden die antigenen Zuckermoleküle ab, die den Typ‑A‑Status definieren, und legen damit die neutrale chemische Struktur frei, die einer Typ‑O‑Oberfläche entspricht. "Sobald das erledigt ist, erkennt das Immunsystem das Organ nicht mehr als fremd", sagt er, und betont, dass dies die erste Erprobung der Methode in einem humanen Modell darstellt. Diese Beschreibung hilft, die Idee der enzymatischen Umwandlung verständlich zu machen: Es handelt sich um gezielte chemische Modifikation statt um genetische Manipulation des Spenderorgans.
Was die experimentelle Transplantation zeigte — und was nicht
Die konvertierte Niere wurde in einen hirntoten Spender transplantiert, der über seine Familie der Nutzung für Forschungszwecke zugestimmt hatte; das Organ funktionierte mehrere Tage im Empfänger. Dieser Zeitraum aktiver Funktion lieferte den Wissenschaftlern wertvolle Echtwelt‑Daten darüber, wie das Immunsystem reagiert, wenn die ABO‑Marker eines Organs chemisch entfernt wurden. Solche Daten sind kritisch, denn Tiermodelle können immunologische Feinheiten und klinische Komplikationen menschlicher Transplantationen nicht immer vollständig abbilden.
Allerdings war die Konversion nicht dauerhaft. Am dritten Tag nach der Transplantation begannen sich die Typ‑A‑Marker wieder auf dem Gewebe der Niere zu zeigen, was eine Immunantwort auslöste. Kritisch daran ist, dass die Reaktion weniger heftig ausfiel, als man normalerweise bei einer fehlangepassten Transplantation erwarten würde; es gab zudem Hinweise darauf, dass sich die Biologie des Wirts eher in Richtung Toleranz als in Richtung vollständiger Abstoßung bewegte. Diese Beobachtungen deuten an, dass eine temporäre Antigenentfernung das Immunsystem möglicherweise in einen günstigeren Zustand überführen kann, der die frühe Phase nach der Transplantation weniger riskant macht.
Gleichzeitig unterstreicht die erneute Expression der Antigene eine zentrale Herausforderung: Wie lässt sich die Antigenentfernung so stabilisieren, dass sie für den Einsatz bei lebenden Empfängern zuverlässig und dauerhaft ist? Mögliche Ursachen für die Wiederkehr der Marker sind die natürliche Zellregeneration, endogene Biosynthesewege im Spendergewebe oder unvollständige Entfernung in bestimmten Gewebekompartimenten. Diese Mechanismen müssen genauer untersucht werden, um robuste Gegenstrategien zu entwickeln.
Kontext: warum dies die Logistik von Nierentransplantationen verändern könnte
Der Mangel an Nieren ist dramatisch. Allein in den Vereinigten Staaten sterben schätzungsweise rund 11 Menschen pro Tag, während sie auf eine Nierentransplantation warten, und viele dieser Todesfälle betreffen Patienten, die eine Niere vom Typ O benötigen. Aktuelle klinische Strategien zur Überwindung von Blutgruppeninkompatibilitäten — die sogenannten Desensibilisierungsprotokolle — können zwar funktionieren, sind aber zeitaufwändig, mit Risiken verbunden und teuer. Darüber hinaus erfordern diese Protokolle in der Regel, dass der Empfänger im Voraus bekannt ist, was die schnelle Vermittlung von Organen bei verstorbenen Spendern erschwert.
Eine verlässliche Methode zur Umwandlung von Spendernieren in eine universelle Form könnte den Pool nutzbarer Organe dramatisch vergrößern, Wartezeiten verkürzen und die Sterblichkeit auf Transplantationslisten senken. Logistisch würde dies bedeuten, dass anstelle einer exakten ABO‑Anpassung oder langwieriger Desensibilisierung Behandler die Option hätten, ein Organ ex vivo — also außerhalb des Körpers — zu behandeln und die Transplantation schneller durchzuführen. Dies könnte die gerichtete Verteilung von Spenderorganen vereinfachen, die Effizienz des Organzuteilungssystems verbessern und die Nutzung verfügbarer Spendernieren optimieren.
Wichtig für die Versorgungssysteme ist außerdem, dass eine Reduktion der Abhängigkeit von passenden Blutgruppen die Notwendigkeit für aufwendige und kostspielige Vorbehandlungen verringern könnte. Für Patienten würde dies eine schnellere Transplantation und potenziell weniger Zeit in Dialysezentren bedeuten, was Lebensqualität und langfristiges Outcome verbessert. Für Transplantationszentren würden sich Planungsprozesse sowie Lagerung und Transport von Organen ändern — von einem stark individualisierten Matching hin zu einem flexibleren, technikorientierten Workflow.
Wissenschaftliche Hürden und nächste Schritte
Mehrere technische und klinische Fragen bleiben offen, bevor dieser Ansatz bei lebenden Patienten angeboten werden kann. Zu den wichtigsten Fragen zählen: Wie verhindert man, dass Antigene nach einer Enzymbehandlung wieder auftauchen? Wie skaliert man Enzymbehandlungen, damit sich Hunderte oder Tausende Organe effizient und sicher behandeln lassen? Und wie stellt man sicher, dass die Konversion keine neuen Verwundbarkeiten schafft — etwa eine erhöhte Infektionsanfälligkeit oder eine schädliche Aktivierung des Immunsystems?
Forschende erwägen ergänzende Strategien: Die Kombination der Antigenentfernung mit gezielter Immunmodulation, die Verbesserung der Enzympotenz und -retention auf dem Gewebe, oder die Verbindung der Konversion mit anderen Innovationen wie gentechnisch veränderten Antikörpern oder Xenotransplantation (etwa Schweine-Nieren). Technisch könnte man auch daran arbeiten, Enzyme lokal zu immobilisieren oder modifizierte Enzymvarianten zu verwenden, die länger aktiv bleiben und weniger Nebenprodukte produzieren. Ferner sind Longitudinalstudien in Tiermodellen sowie zusätzliche Experimente in humanen Modellen erforderlich, um Sicherheitsprofile, Langzeitwirkungen und mögliche Komplikationen zu erfassen.
Darüber hinaus sind regulatorische, ethische und logistische Rahmenbedingungen zu klären: Wie werden solche umgewandelten Organe bewertet und zertifiziert? Welche Zustimmungserfordernisse gelten für Spender und Empfänger? Und wie lassen sich diese Verfahren in bestehende Transplantationsnetzwerke integrieren, ohne Versorgungsungleichheiten zu verschärfen? Die Beantwortung dieser Fragen ist ebenso wichtig wie die rein wissenschaftliche Weiterentwicklung der Methode.
Expertinneneinschätzung
"Dies ist ein wohlüberlegter, aber spannender Fortschritt", sagt Dr. Maya Patel, eine Transplantationsimmunologin, die nicht an der Studie beteiligt war. "Das Demonstrieren von kurzfristiger Funktion in einem humanen Modell ist ein wichtiger Meilenstein. Die nächste Aufgabe besteht darin, Persistenz zu konstruieren — also sicherzustellen, dass das Antigenprofil nicht Tage oder Wochen später zurückkehrt. Wenn Wissenschaftler die Konversion dauerhaft fixieren können oder sie mit selektiver Immunsteuerung kombinieren, könnte der Einfluss auf Wartelisten enorm sein."
Parallel beobachten Wissenschaftler weitere Wege: verbesserte Matching‑Algorithmen, eine intensivere Nutzung lebender Spender und gentechnisch veränderte tierische Organe. Zusammengenommen zeigen diese Ansätze einen vielschichtigen Angriff auf das globale Problem der Organverknappung — von algorithmischen Verbesserungen über biologische Innovationen bis hin zu systemischen Veränderungen in der Organzuteilung.
Was das für Patientinnen und Patienten sowie das Gesundheitssystem bedeutet
Für Patientinnen und Patienten würde eine sichere, zuverlässige universelle Niere weniger Monate oder Jahre an Dialyse bedeuten und die Sterblichkeit während des Wartens reduzieren. Dialyse ist nicht nur belastend für die Lebensqualität, sondern verursacht auch hohe Kosten und Folgeerkrankungen. Für Gesundheitssysteme könnte eine Reduktion der Dialysezeit erhebliche Einsparungen bringen, da die langjährigen Kosten für wiederholte Dialysebehandlungen und komplexe Desensibilisierungsverfahren entfallen oder sinken würden.
Für die Forschung stellt der Ansatz eine klare ingenieurwissenschaftliche und immunologische Aufgabenstellung dar: Wie macht man eine molekulare Lösung dauerhaft anwendbar, sicher und reproduzierbar? Die Übersetzung einfacher biochemischer Prinzipien in klinische Praxis erfordert interdisziplinäre Arbeit zwischen Biochemikern, Transplantationschirurgen, Immunologen, Regulatorik‑Experten und Logistikern. Der veröffentlichte Bericht in Nature Biomedical Engineering ist ein konkretes Beispiel dafür, wie Grundlagenforschung in Richtung patientenorientierter Anwendung wirken kann.
Wie Withers über den Fortschritt des Teams bemerkte: Die Beobachtung, wie Laborerkenntnisse näher an die klinische Realität rücken, ist genau die Motivation für diese langfristige Arbeit. Gleichzeitig bleibt realistisch: Zwischen einem erfolgreichen experimentellen Modell und der breiten klinischen Anwendung liegen noch wissenschaftliche Validierung, klinische Studien und regulatorische Prüfungen.
Die Kombination aus Enzymkonversion, verbesserter Transplantationslogistik und ergänzenden immunologischen Strategien könnte jedoch langfristig die Art und Weise verändern, wie Spendernieren zugeteilt und transplantiert werden. Sollte sich die Methode als sicher, dauerhaft und skalierbar erweisen, wäre das ein Meilenstein für die Organtransplantation, mit direktem Nutzen für Patientinnen, Patienten und das Gesundheitssystem gleichermaßen.
Quelle: sciencealert

Kommentar hinterlassen