7 Minuten
Forscher an der University of Massachusetts Amherst berichten von einem Nanopartikel-Impfstoff, der in Mäusen über die gesamte Studienzeit von 250 Tagen mehrere Tumorarten verhinderte. Die experimentelle Formulierung kombiniert krebsspezifische Antigene mit einem potenten "Super"-Adjuvans, um das Immunsystem darauf zu trainieren, Tumorzellen frühzeitig zu erkennen und zu zerstören, bevor sich Tumoren etablieren können. Diese präklinischen Ergebnisse deuten auf neue Ansätze für präventive Krebstherapien hin, insbesondere im Bereich der Immunprophylaxe und der immunologischen Krebsprävention.
Wie der Impfstoff das Immunsystem schult
Der Impfstoff nutzt lipidbasierte Nanopartikel, um einen erkennbaren Ausschnitt von Krebszellen als Antigen darzustellen — ein molekularer Marker, der für Immunzellen als Bedrohung fungiert. Neben diesen Antigenen sind sogenannte Super-Adjuvantien eingekapselt: zwei Immunstimulanzien, die gemeinsam innerhalb der Nanopartikel geliefert werden, um Reichweite und Stärke der Immunantwort zu erhöhen. Durch die gleichzeitige Präsentation von Antigenen und starken Aktivatoren wird das Immunsystem praktisch "trainiert": antigenpräsentierende Zellen wie dendritische Zellen nehmen die Partikel auf, verarbeiten die Antigene und aktivieren sowohl CD8+-zytotoxische T-Zellen als auch CD4+-Helferzellen. Dies fördert eine koordinierte adaptive Immunantwort, die Tumorzellen gezielt angreift und eliminiert.
Technisch gesehen fördert die Formulierung die antigene Kreuzpräsentation über MHC-Klasse-I- und -Klasse-II-Weg, was entscheidend ist, um langlebige zytotoxische T-Zellen und humorale Antworten zu induzieren. Die Kombination von zwei Adjuvantien kann verschiedene angeborene Immunrezeptoren stimulieren — etwa Toll-like-Rezeptoren (TLRs) oder den STING-Signalweg — und dadurch ein breiteres Cytokinprofil auslösen. Ein solches Multi-Pathway-Aktivierungsprofil erhöht die Wahrscheinlichkeit, dass sich eine robuste immunologische Gedächtnispopulation bildet, die bei erneutem Antigenkontakt rasch reagiert.
Warum Nanopartikel?
Nanopartikel sind winzige Träger, die fragile Moleküle schützen, die Freisetzung steuern und Komponenten gleichzeitig an dieselben Immunzellen liefern können. Durch das Co-Encapsulieren von Antigenen und Adjuvantien werden mehrere Immunwege synchron angesprochen, was oft zu einer koordinierteren und dauerhafteren Reaktion führt als bei Ein-Komponenten-Formulierungen. Lipidnanopartikel bieten dabei Vorteile wie verbesserte Aufnahme durch antigenpräsentierende Zellen, Lymphknoten-Targeting und reduzierte systemische Verteilung, wodurch Nebenwirkungen potenziell verringert werden können.
Darüber hinaus lassen sich Nanopartikel in Bezug auf Größe, Oberflächenladung und Liganden modifizieren, um die Aufnahme durch dendritische Zellen zu optimieren oder die Drainage in proximale Lymphknoten zu fördern, wo adaptive Immunantworten initiiert werden. Kontrollierte Freisetzungsprofile erlauben es zudem, die zeitliche Korrelation zwischen Antigen- und Adjuvanzufuhr zu steuern — ein Schlüsselmerkmal für die Ausbildung effektiver Gedächtnisantworten. Zusammengefasst steigern Nanopartikel die Effizienz der Antigenpräsentation und können gleichzeitig die Immunogenität verbessern, ohne unnötig systemische Entzündungen zu verursachen.
Ergebnisse: Überleben, Kreuzschutz und Dauerhaftigkeit
In der ersten Versuchsreihe beluden die Forscher Nanopartikel mit melanomaspezifischen Peptiden und impften Mäuse vor einer späteren Exposition gegenüber Melanomzellen. Das Ergebnis war bemerkenswert: 80 Prozent der geimpften Tiere überlebten und blieben während der vollen Beobachtungsdauer von 250 Tagen tumorfrei. Im Gegensatz dazu entwickelten die nicht geimpften Kontrollen sowie Tiere, die alternative Formulierungen erhielten, innerhalb von sieben Wochen Tumoren und verstarben. Diese Unterschiede deuten auf eine starke prophylaktische Wirkung des nanopartikelbasierten Impfstoffs hin.
Um den Schutz gegen verschiedene Tumortypen zu testen, verwendete das Team anschließend ein allgemeineres Antigen — Tumorlysat. Tumorlysat entsteht durch Aufschluss von Tumorzellen und enthält ein komplexes Gemisch aus tumorassoziierten Proteinen und Peptiden, das multiple Antigene bereitstellt. Mäuse, die mit der Lysatformulierung geimpft wurden, wurden dann gegen drei Krebsmodelle herausgefordert: Melanom, Bauchspeicheldrüsenkrebs (Pankreaskarzinom) und triple-negativen Brustkrebs (TNBC). Die Schutzraten waren tumorabhängig, aber insgesamt signifikant: Im Pankreasmodell blieben 88 Prozent tumorfrei, im TNBC-Modell 75 Prozent und im Melanom-Modell 69 Prozent.
Solche Daten deuten auf einen substantiellen Kreuzschutz hin, der aus der Breite der durch Tumorlysat präsentierten Antigene resultiert. Anstelle einer Ein-Target-Strategie, die nur gegen eine einzelne Mutation oder ein Peptid gerichtet ist, bietet das Lysat-Ansatz das Potenzial, heterogene Tumorzellpopulationen zu adressieren, wie sie in klinischen Tumoren häufig vorkommen. Diese Breite kann besonders wichtig sein, um Tumorzellvarianten zu verhindern, die ansonsten durch Antigendrift oder intra-tumorale Heterogenität entkommen würden.
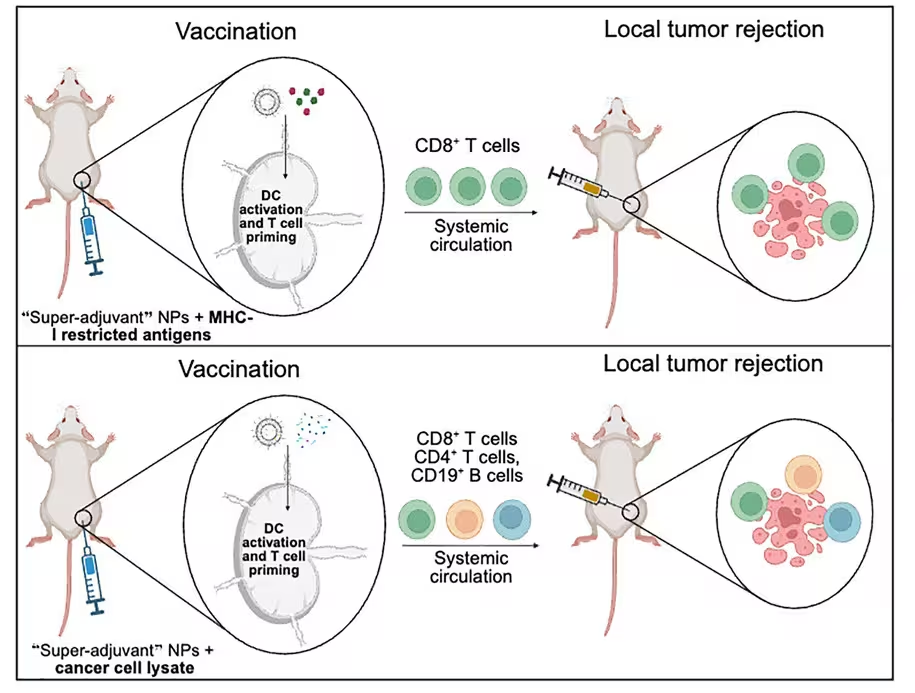
Eine grafische Zusammenfassung, wie der Krebsimpfstoff wirkt. (Kane et al., Cell Rep. Med. 2025)
In Nachfolgeexperimenten versuchte das Team, die Tumorausbreitung zu imitieren und prüfte, ob überlebende Tiere langfristig immunologisch geschützt blieben. Dabei blieb jedes überlebende Tier tumorfrei, was auf einen robusten und langlebigen immunologischen Gedächtniseffekt hinweist. "Indem wir diese Nanopartikel so konstruieren, dass sie das Immunsystem über Multi-Pathway-Aktivierung in Kombination mit krebsspezifischen Antigenen aktivieren, können wir Tumorwachstum mit bemerkenswerten Überlebensraten verhindern", erklärt Prabhani Atukorale, Biomedizintechniker an der UMass Amherst. Solche Befunde unterstützen die Hypothese, dass eine Kombination aus breiter Antigenpräsentation und starker angeborener Stimulation die Voraussetzung für nachhaltigen Schutz bildet.
Immunologisch lässt sich die Dauerhaftigkeit durch die Bildung langlebiger zentraler und efektorgedächtnis T-Zellen erklären, unterstützt durch persistente Gedächtnis-B-Zellen und neutralisierende Antikörper in bestimmten Modellen. Zusätzlich können wiederholte Antigenkontakte oder Boost-Impfungen eingesetzt werden, um Gedächtnisantworten bei Bedarf zu verstärken, ohne die anfängliche Toleranzschwelle zu überschreiten.
Folgen, Grenzen und nächste Schritte
Diese Ergebnisse, veröffentlicht in Cell Reports Medicine, weisen auf eine flexible Plattform hin, die angepasst werden könnte, um verschiedene Krebsarten zu adressieren oder prophylaktisch bei Hochrisikopatienten eingesetzt zu werden. Die Nutzung von Tumorlysat deutet auf einen nahezu universellen Ansatz hin, bei dem ein einziger Impfstoff das Immunsystem gegen ein Spektrum von Tumorantigenen primen kann, statt nur gegen eine einzelne Mutation oder ein einzelnes Peptid. Solche Strategien könnten besonders wertvoll für Patienten mit genetisch erhöhtem Krebsrisiko (z.B. BRCA-Mutationen) oder für Personen nach erfolgreicher Tumorentfernung sein, um Rezidive zu verhindern.
Die Autoren betonen jedoch eine wichtige Einschränkung: Die Experimente wurden in Mäusen durchgeführt. Tiermodelle sind für frühe Tests unverzichtbar, garantieren aber weder Sicherheit noch Wirksamkeit beim Menschen. Vor jeglicher klinischer Anwendung sind umfangreiche präklinische Sicherheitsprüfungen erforderlich, einschließlich Toxizitätsstudien, Biodistributionsanalyse und Assessment potenzieller Autoimmunreaktionen. Ebenso müssen Dosisfindungsstudien und ein sorgfältiges Abwägen der Adjuvanzusammensetzung durchgeführt werden, um die Balance zwischen Wirksamkeit und Verträglichkeit zu optimieren.
Klinische Translation erfordert mehrere Entwicklungsstufen: GMP-konforme Herstellungsprozesse für Nanopartikel, Stabilitätsprüfungen, Skalierung der Produktion sowie regulatorische Abklärungen zu Qualitätsattributen und Freigabeparametern. Erste Phase-I-Studien würden primär Sicherheit und immunologische Endpunkte messen — etwa T-Zell-Antworten, Antikörperbildung, Zytokinprofile und Biomarker für Entzündung — bevor größere Studien auf klinische Wirksamkeit und onkologische Endpunkte zielen.
Weitere Herausforderungen betreffen die Patientenselektion und das Studiendesign: Welche Patientengruppen profitieren am meisten? Sind prophylaktische Impfungen bei Hochrisikogruppen sinnvoller als therapeutische Ansätze bei bereits manifesten Tumoren? Wie lassen sich Kombinationen mit bestehenden Immuntherapien (z. B. Checkpoint-Inhibitoren) oder konventionellen Therapien (Operation, Chemotherapie, Bestrahlung) am besten integrieren? Antworten auf diese Fragen erfordern translational gut abgestimmte Studien und enge Zusammenarbeit zwischen Grundlagenforschung, klinischer Onkologie und Regulatorik.
- Wissenschaftlicher Kontext: Nanopartikel-Delivery und Multi-Adjuvans-Strategien sind ein wachsender Trend in der Immuntherapie und Präventionsforschung.
- Kernentdeckung: Starke, dauerhafte Tumorprävention in mehreren Maus-Krebsmodellen über 250 Tage.
- Nächste Schritte: Sicherheitsprüfungen, Feinabstimmung der Formulierung und gegebenenfalls klinische Studien, falls präklinische Daten eine Translation unterstützen.
Diese Forschung baut auf bestehenden Bemühungen auf, Impfstoffe zu entwickeln, die nicht nur behandeln, sondern auch Krebs verhindern können, und liefert eine potenzielle Roadmap für zukünftige immunpräventive Strategien in der Onkologie. Langfristig könnten Nanopartikel-basierte Krebsimpfstoffe sowohl individualisierte als auch "breit angelegte" Präventionsansätze ermöglichen — je nach Tumorbiologie, Patientenrisiko und klinischem Bedarf. Entscheidend für die praktische Umsetzung werden jedoch robuste Sicherheitsdaten, reproduzierbare Herstellungsprozesse und sorgfältig konzipierte klinische Studien sein, die den Nutzen-Risiko-Parameter in verschiedenen Patientengruppen klar definieren.
Quelle: sciencealert

Kommentar hinterlassen