9 Minuten
Eine kleine klinische Studie in den Vereinigten Staaten deutet darauf hin, dass zwei neu eingesetzte Medikamente – ein Diabetesmedikament und ein intranasales Insulinspray – möglicherweise sicher Biomarker der Hirngesundheit bei Menschen mit erhöhtem Alzheimer-Risiko verbessern können. Die Studie konzentrierte sich auf metabolische und neurovaskuläre Messgrößen, die mit frühem kognitiven Abbau in Verbindung gebracht werden, und lieferte ermutigende Hinweise, die größere und längerfristige Studien rechtfertigen.
Warum Forschende Stoffwechsel und Blutfluss anvisierten
Alzheimer und verwandte Demenzen sind biologisch komplex, und ihre Behandlung wird wahrscheinlich mehrere komplementäre Strategien erfordern. Anstatt ausschließlich auf spät auftretende Kennzeichen wie große Amyloid-Plaques zu zielen, prüfte die Studie Interventionen, die den zellulären Stoffwechsel, Entzündungsprozesse und die Hirnperfusion beeinflussen — Vorgänge „stromaufwärts“, die Neuronen widerstandsfähiger machen können.
Die Wahl, Stoffwechsel und zerebrovaskuläre Gesundheit zu adressieren, basiert auf zunehmend konsistenten Befunden: metabolische Dysregulation, systemische und neuronale Insulinresistenz sowie gestörte Durchblutung sind frühe Beiträge zur Pathogenese der Alzheimer-Krankheit. Diese Faktoren beeinflussen Energieversorgung, synaptische Funktion und immunologische Antworten im Zentralnervensystem, und sie lassen sich potenziell pharmakologisch modulieren.
Die beiden getesteten Interventionen waren Empagliflozin, ein etabliertes Medikament aus der Klasse der SGLT2-Inhibitoren, das primär zur Behandlung von Typ-2-Diabetes und zur kardiovaskulären Risikoreduktion eingesetzt wird, sowie ein nasales Insulinspray, das Insulin gezielt in das Gehirn liefern soll. Empagliflozin verändert die Glukose- und Natriumhandhabung in Niere und peripheren Geweben, führt zu einer gesteigerten Glukoseausscheidung und einer natriuretischen Wirkung, reduziert damit verbundenen zellulären Stress und systemische Entzündung und kann die Energieeffizienz auf zellulärer Ebene beeinflussen. Intranasales Insulin zielt darauf ab, der Insulinresistenz im Gehirn entgegenzuwirken — ein Faktor, der zunehmend mit kognitivem Abbau in Verbindung gebracht wird — und gleichzeitig neuronale Gesundheit, Synapsenfunktion und immunologische Regulation im zentralen Nervensystem zu unterstützen.
Trial-Design und Teilnehmende
Die Phase-II-Sicherheitsstudie rekrutierte 47 Erwachsene im Alter von 55 bis 85 Jahren; 42 Teilnehmende schlossen das vierwöchige Protokoll ab. Die Studienpopulation umfasste Personen mit leichter kognitiver Beeinträchtigung (MCI) oder leichter Demenz sowie kognitiv normale Freiwillige, bei denen molekulare Hinweise auf Alzheimer in Biomarker-Tests nachgewiesen wurden. Die Probanden wurden randomisiert in vier Arme eingeteilt: Empagliflozin allein, nasales Insulin allein, beide Behandlungen kombiniert oder Placebo.
Da das primäre Ziel in erster Linie die Bewertung von Sicherheit und Verträglichkeit über einen kurzen Zeitraum war, war die Studie nicht darauf ausgelegt, eine endgültige Wirksamkeit nachzuweisen. Dennoch erhoben die Forschenden ein breites Spektrum an Biomarkern und bildgebenden Ergebnissen — Liquoruntersuchungen (CSF-Assays), kognitive Tests, weiße Substanz-Konnektivität in der MRT (zum Beispiel DTI), Messungen der zerebralen Durchblutung (z. B. ASL), sowie Cholesterin- und Entzündungsmarker — um frühe Trends zu identifizieren. Solche multidimensionalen Endpunkte sind wichtig, weil Alzheimer ein multifaktorielles Geschehen ist und einzelne Biomarker allein selten das ganze Bild liefern.
Die Einschlusskriterien und die Stratifizierung nach klinischem Status ermöglichten es, Signale sowohl bei Personen mit bereits vorhandener, leichter kognitiver Beeinträchtigung als auch bei präklinisch betroffenen, biomarkerpositiven, kognitiv normalen Personen zu untersuchen. Die kurze Behandlungsdauer ist typisch für Phase-II-Sicherheitsstudien, erlaubt jedoch nur begrenzte Aussagen zur langfristigen Wirksamkeit auf klinische Endpunkte wie Alltagsfunktionen oder Demenzprogression.
Wesentliche Ergebnisse: Signale bei Tau, Kognition und Durchblutung
Obwohl die Unterschiede zwischen den Gruppen aufgrund der geringen Stichprobengröße und der kurzen Behandlungsdauer keine statistische Signifikanz erreichten, traten mehrere bemerkenswerte Muster zutage. Personen, die nur Empagliflozin erhielten, zeigten Verringerungen der Tau-Werte im Liquor (CSF) — eines Proteins, das sich in toxischen Neurofibrillenbündeln im Alzheimer-Gehirn anhäufen kann — zusammen mit Verbesserungen der zerebralen Durchblutung und bestimmten Lipidparametern, die mit Demenzrisiko in Verbindung stehen.
Die Reduktion von CSF-Tau und gegebenenfalls phosphoryliertem Tau (p-Tau) ist bedeutsam, weil diese Proteine eng mit neurodegenerativen Prozessen und Neuronenschädigung korrelieren. Veränderungen in Lipidprofilen, inklusive spezifischer Lipoprotein-Fraktionen, könnten Mechanismen widerspiegeln, über die systemischer Stoffwechsel die neurodegenerative Entwicklung beeinflusst. Empagliflozin wirkt als SGLT2-Inhibitor nicht nur auf Glukosewerte, sondern moduliert auch hämodynamische und inflammatorische Pfade, die potenziell tau-bezogene Pathologien indirekt beeinflussen.
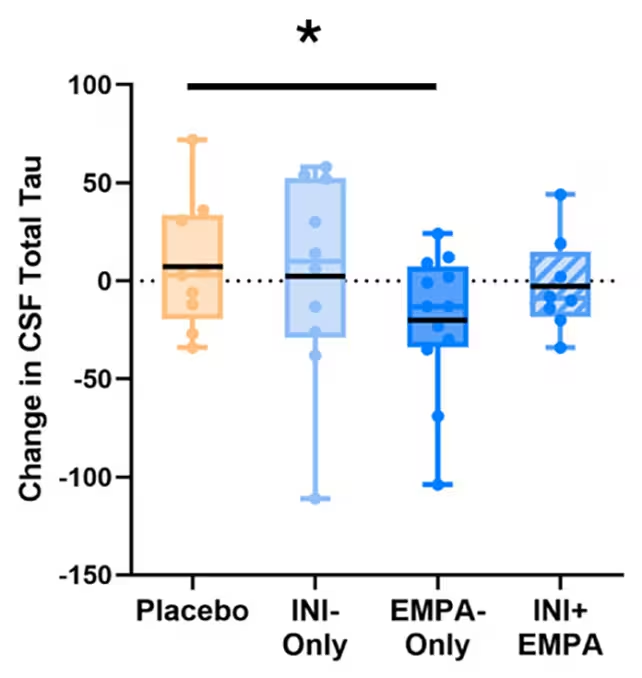
Einer der beobachteten Effekte unter Empagliflozin (EMPA-Only) war ein Hinweis auf geringere Tau-Akkumulation im Liquor (CSF). (Erichsen et al., A&D, 2025)
Teilnehmende, die das intranasale Insulin erhielten, erzielten innerhalb des kurzen Versuchszeitraums bessere Ergebnisse in Erinnerungstests und Aufgaben zur exekutiven Funktion. Bildgebende Untersuchungen zeigten bei diesen Personen außerdem eine verbesserte Konnektivität der weißen Substanz und eine gesteigerte Perfusion in Regionen, die mit Gedächtnisprozessen verbunden sind — Ergebnisse, die zu früheren Studien passen, die einen Zusammenhang zwischen Insulin-Signalgebung und neurovaskulärer Gesundheit nahelegen. Eine bessere Perfusion kann die Glukose- und Sauerstoffzufuhr für aktive Neurone steigern und synaptische Plastizität fördern.
Insgesamt deuten diese Muster darauf hin, dass unterschiedliche pharmakologische Ansätze verschiedene, sich ergänzende Aspekte der Alzheimer-Pathobiologie adressieren können: während Empagliflozin systemische metabolische Stressfaktoren und inflammatorische Pfade moduliert, stärkt intranasales Insulin direkt neuronale Signalwege und synaptische Funktion.
Wie diese Medikamente zusammenwirken könnten
Die Studie stützt ein Modell, in dem metabolische Modulation und gezielte neuroendokrine Unterstützung komplementäre Effekte haben. Empagliflozin scheint systemische Entzündungsprozesse und zellulären Stress zu reduzieren und dadurch potenziell die Progression von Tau-Pathologien zu verlangsamen. Als SGLT2-Inhibitor kann Empagliflozin ferner hämodynamische Effekte entfalten, die die kardiovaskuläre und zerebrale Perfusion beeinflussen — Faktoren, die langfristig neuroprotektiv sein könnten.
Intranasales Insulin wirkt offenbar direkter im Gehirn: Es kann neuronalen Stoffwechsel, synaptische Übertragung und immunologische Regulation stärken, indem es Insulinrezeptor-vermittelte Signalwege reaktiviert. Durch die nasale Applikationsroute wird das Insulin zum Teil an der Blut-Hirn-Schranke vorbeigeführt und erlaubt so eine gezieltere Wirkung im ZNS ohne größere systemische Hypoglykämierisiken, vorausgesetzt, die Dosierung ist korrekt etabliert.
In Kombination könnten beide Ansätze ein günstiges Gleichgewicht schaffen: Empagliflozin reduziert systemische Risikofaktoren und inflammatorische Belastung, während intranasales Insulin neuronale Signalwege und synaptische Resilienz direkt unterstützt. Dies könnte die Immunantwort des Gehirns in eine protektive Richtung lenken, ohne eine schädliche Neuroinflammation zu fördern. Solche Synergien sind besonders relevant für Kombinationstherapien, die früh in der Krankheitskaskade ansetzen sollen.
Sicherheit und Einschränkungen
In dieser kurzen Untersuchung wurden keine schwerwiegenden unerwünschten Ereignisse berichtet, und beide Behandlungen wurden über die Altersgruppen und klinischen Subtypen hinweg gut toleriert. Dennoch betonen die Autorinnen und Autoren die wichtigsten Einschränkungen der Studie: die kleine Stichprobengröße, die kurze Expositionsdauer (vier Wochen) und die explorative Natur zahlreicher Biomarker-Endpunkte.
Aus klinischer Sicht sind vier Wochen für die Bewertung dauerhafter Veränderungen in Neurodegeneration oder funktioneller Krankheitsschwere eindeutig zu kurz. Viele relevante Effekte — etwa Stabilisierung von kognitiven Leistungen, Verzögerung der Demenzprogression oder nachhaltige Veränderungen in strukturellen MRT-Maßen — erfordern längere Follow-up-Zeiträume und größere, ausreichend powerberechnete Kohorten. Zudem bleibt offen, welche Subgruppen am meisten profitieren (z. B. nach Alter, Genetik wie APOE-Status, metabolischem Profil oder Vorhandensein bestimmter Biomarker).
Weiterhin ist zu beachten, dass Biomarker-Veränderungen wie reduzierte CSF-Tau-Werte zwar vielversprechend sind, aber nicht automatisch in einen klinisch relevanten Nutzen übersetzt werden. Validierte, klinisch relevante Endpunkte und reproduzierbare Ergebnisse in unabhängigen, größeren Studien sind notwendig, bevor diese Therapien in der Routineversorgung empfohlen werden können.
Nächste Schritte: Hochskalierung und Kombinationstherapie
Die Forscher planen, diese Therapien in größeren Kohorten mit längerer Nachbeobachtung zu testen, um Effekte auf Kognition, funktionellen Abbau und validierte Alzheimer-Biomarker quantifizieren zu können. Solche Studien sollten randomisiert, doppelt verblindet und ausreichend lange angelegt sein, um sowohl subtile biomolekulare Veränderungen als auch klinisch relevante Endpunkte zu erfassen.
Die Aussicht, ein zugelassenes Diabetesmedikament (Empagliflozin) und ein gezieltes Insulin-Liefergerät zu repurposen, ist attraktiv, weil beide Ansätze bereits Daten zur Sicherheit vorweisen und damit potenziell schneller für Betroffene verfügbar werden könnten, falls spätere, größere Studien Wirksamkeit zeigen. Dies ist ein pragmatischer Weg in der translationalen Forschung: vorhandene Medikamente mit bekanntem Sicherheitsprofil werden auf neue Indikationen geprüft, wodurch Entwicklungszeit und -kosten reduziert werden können.
Wichtig für zukünftige Studien sind stratifizierte Subgruppenanalysen (z. B. nach APOE-Genotyp oder metabolischem Status), Kombinationen mit Lebensstilinterventionen (Ernährung, Bewegung) sowie eine sorgfältige Überwachung von Biomarkern wie P-Tau, Aβ42/40, Neurofilament light chain (NfL) und bildgebenden Parametern (DTI, ASL). Ebenfalls relevant sind pharmakokinetische Daten zum nasalen Insulin und längerfristige Sicherheitsdaten bei älteren Patientinnen und Patienten mit multimorbiden Begleiterkrankungen.
Expertinnen- und Experteneinschätzung
Dr. Maria Alvarez, Neurologin und klinische Forscherin, die nicht an der Studie beteiligt war, kommentierte: "Diese Studie ist ein Beispiel für pragmatische, mechanistisch geprägte Forschung. Stoffwechsel und vaskuläre Gesundheit frühzeitig anzusprechen, hat aus physiologischer Sicht Sinn. Die Signale sind moderat, aber konsistent genug, um größere Studien zu rechtfertigen, die einen echten Nutzen in der Praxis testen können."
Zusammenfassend heben die Befunde Stoffwechsel- und neurovaskuläre Gesundheit als handhabbare Ansatzpunkte im Kampf gegen Alzheimer hervor und eröffnen eine Perspektive für Kombinationstherapien, die früher in der Krankheitspyramide intervenieren. Die vorliegenden Ergebnisse sind als frühe, hypothesisgenerierende Hinweise zu verstehen: Sie liefern rationale und methodische Grundlagen für Weiterentwicklungen in klinischen Studien, aber keine sofortige Änderung klinischer Leitlinien.
Technisch gesehen illustriert diese Studie, wie multimodale Endpunktbatterien — molekulare Biomarker, struktur- und funktionelle Bildgebung sowie neuropsychologische Tests — kombiniert werden können, um ein umfassenderes Bild von Wirkmechanismen zu zeichnen. Solche Ansätze erhöhen die Wahrscheinlichkeit, therapeutische Wirkungen zu erkennen, die sich über mehrere biologische Ebenen erstrecken. Für die klinische Praxis bleibt zu hoffen, dass zukünftige, größere Studien die initialen Signale bestätigen und so neue, sichere Behandlungsstrategien für Menschen mit Alzheimer-Risiko liefern.
Quelle: sciencealert

Kommentar hinterlassen