8 Minuten
Kraken, Tintenfische und ihre cephalopoden Verwandten sind berühmt für ihre scheinbar magischen Verschwinde- und Farbwechseltricks. Das Geheimnis hinter ihren schnellen Farbumschlägen beinhaltet ein seltenes Pigment namens Xanthommatin — bis vor kurzem praktisch nicht in größeren Mengen verfügbar. Ein Forscherteam unter Leitung von Wissenschaftlern der UC San Diego hat nun Bakterien so gentechnisch verändert, dass sie dieses Pigment effizient produzieren. Damit eröffnen sich neue Wege zum besseren Verständnis der Cephalopoden-Tarnung und zur ökologischeren Herstellung chemischer Stoffe.
Wie Forschende Mikroben zur Produktion eines Cephalopoden-Pigments bewegten
Die Labordarstellung von Xanthommatin war lange unpraktikabel: Die Gewinnung aus Tieren ist ineffizient, die chemische Synthese liefert oft geringe Ausbeuten und ist kostenintensiv. Um diesen Engpass zu überwinden, wendeten die Forschenden einen modernen Ansatz der synthetischen Biologie an: Mikroben so zu programmieren, dass sie komplexe Naturstoffe herstellen können, statt sie aus natürlichen Quellen zu extrahieren oder auf teure Syntheserouten zurückzugreifen.
Anstatt nur Gene für die Pigmentsynthese einzufügen und auf zufälligen Erfolg zu hoffen, entwickelten die Autoren eine Strategie, die sie als "wachstumsgekoppelte Biosynthese" (engl. "growth-coupled biosynthesis") bezeichnen. Konkret wurde das Metabolismus-Design so umgebaut, dass das Überleben und die Zellteilung der Bakterien an die gleichzeitige Produktion von zwei Verbindungen gekoppelt sind: dem Zielpigment Xanthommatin und Ameisensäure (Formiat), die als metabolischer Treibstoff fungiert. Durch diese Verbindung von Produktbildung und Fitness erzeugten die Forscher eine starke Selektionskraft zugunsten der Pigmentproduktion.
Bakterien dazu bringen, Pigment gegenüber Sparsamkeit zu wählen
Bakterien folgen energetischen Prinzipien: Sie verschwenden keinen Aufwand für nicht essentielle Produkte. Die Forscher nutzten diese Effizienzmechanik, indem sie die Pigmentbildung zur essentiellen Voraussetzung für Wachstum machten. Bei jeder Synthese eines Moleküls Xanthommatin entstand gleichzeitig die Menge an Formiat, die für die Zellteilung benötigt wurde. So entstand eine Rückkopplungsschleife, die Zellen zwang, ihre Ressourcen vorrangig in die Herstellung des Zielstoffs zu lenken.
Die Erstautorin Leah Bushin beschrieb die Methode bildhaft als die Erzeugung von "kranken" Zellen, die sich nur durch kontinuierliche Pigmentproduktion wieder erholen. Der Seniorautor Bradley Moore hob hervor, dass dies das erste Mal sei, dass Xanthommatin in einem Bakterium in industriell relevanten Ausbeuten hergestellt wurde. Diese Aussage verweist auf den Unterschied zwischen proof-of-concept in kleinen Maßstäben und der Demonstration sinnvoller Literausbeuten, die für weiterführende Entwicklungsschritte brauchbar sind.
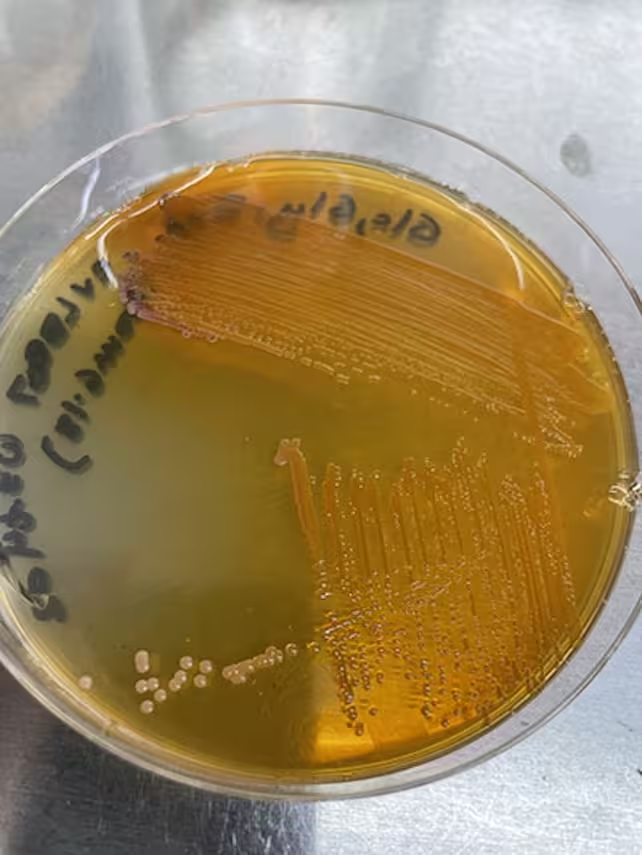
Bakterien, die Xanthommatin auf einer Petrischale im Labor produzieren
Was das Team erreicht hat — und warum das wichtig ist
Die gentechnisch optimierten Stämme erreichten Produktionsniveaus von bis zu etwa 3 Gramm Pigment pro Liter Kulturmedium — das ist rund 1.000-mal höher als frühere Methoden, die nur wenige Milligramm pro Liter lieferten. Zwar erscheinen 3 g/L im Vergleich zu Massenchemikalien moderat, doch für ein strukturell komplexes Naturpigment wie Xanthommatin stellt dies einen deutlichen Durchbruch dar, weil der biotechnologische Zugang damit erstmals praktisch nutzbar wird.
Über die nackten Zahlen hinaus kombinierte die Studie mehrere moderne Werkzeuge: adaptive Labor-Evolution (Adaptive Laboratory Evolution, ALE), damit sich Mikroben unter selektiven Bedingungen selbst optimieren konnten, und Bioinformatikgestützte Optimierung, um Stoffwechselwege zu vereinfachen und Engpässe zu identifizieren. Ziel war es, von einem einzigen einfachen Ausgangssubstrat wie Glukose auszugehen, um die Abhängigkeit von mehreren Nährstoffzufuhren oder aufwändigen manuellem Pathway-Tuning zu minimieren. Durch diese integrative Herangehensweise ließ sich die Komplexität des Prozesses verringern und die Robustheit der Pigmentproduktion erhöhen.
Warum lohnt sich die Jagd nach einem Cephalopoden-Pigment? Für die Biologie bedeutet einfacher Zugang zu Xanthommatin, dass Experimente beschleunigt werden, die untersuchen, wie Cephalopoden Farbe auf zellulärer und molekularer Ebene steuern — etwa wie Pigmente mit refraktiven Strukturen zusammenwirken oder wie neuronale Signale die Chromatophoren modulieren. Für Ingenieure und Materialwissenschaftler eröffnet sich ein natürlicher Farbstoff mit besonderen optischen Eigenschaften, der adaptive Tarnsysteme, reaktionsfähige Beschichtungen oder neue photonische Materialien inspirieren könnte. Im weiteren Sinne ist die Arbeit ein Machbarkeitsnachweis: Die Logik der wachstumsgekoppelten Biosynthese lässt sich potenziell auf andere wertvolle oder schwer herstellbare Verbindungen übertragen und kann so zur nachhaltigeren chemischen Produktion beitragen.
- Wissenschaftlicher Hintergrund: Xanthommatin ist ein Ommochrom-Pigment, das an der Lichtabsorption und Farbanpassung vieler Cephalopoden beteiligt ist; es entsteht biochemisch aus Tryptophan- oder Kynurenin-Vorstufen über mehrstufige Enzymreaktionen.
- Methode im Fokus: Die Kopplung der Zielproduktbildung an das Zellwachstum zwingt Mikroben, Ressourcen in Richtung des gewünschten Metaboliten umzuleiten und reduziert den Selektionsdruck gegen die Produktion.
- Potenzielle Auswirkungen: Von der biologischen Erforschung der Tarnung über biomimetische Materialien bis hin zu nachhaltigeren Biosynthese-Pipelines für Pharmazeutika und Spezialfarbstoffe.
Expertinnen- und Experteneinschätzung
Dr. Maya Chen, eine synthetische Biologin, die nicht an der Studie beteiligt war, kommentierte: "Diese Arbeit vereint elegant evolutionäre Selektion mit rationaler Konstruktionslogik. Indem ein gewünschtes Produkt an die Fitness gekoppelt wird, umgehen die Forschenden manche Trial-and-Error-Phasen, die üblicherweise die Entwicklung neuer Stämme verlangsamen. Es ist ein kraftvoller Ansatz für nachhaltige Bioproduktion — allerdings erfordert die Überführung von Laborergebnissen zu industriellen Fermentern weitere Optimierung und ein sorgfältiges Prozessdesign."
Das Team wies auch auf praktische Herausforderungen hin: Die Skalierung der Produktion bedeutet, Fermentationsprozesse zu optimieren, effiziente Downstream-Verfahren zur Reinigung des Pigments zu entwickeln und regulatorische Prüfungen zu durchlaufen, falls die Pigmente für Anwendungen mit direktem Kontakt zum Menschen oder in Konsumgütern vorgesehen sind. Dabei sind bio‑sicherheits‑ und biosicherheitsrechtliche Rahmenbedingungen zu beachten. Dennoch demonstriert die Studie klar die Machbarkeit: Von gezielten Genomeditierungen bis zu Mengen, die für weitergehende Entwicklungsstufen relevant sind, wurde ein kompletter Pfad aufgezeigt.
Breitere Implikationen und nächste Schritte
Man kann dieses Ergebnis als mehr betrachten als nur eine neue "Pigmentfabrik": Es zeigt eine Methode, Mikroben dazu zu bringen, seltene und strukturell komplexe Naturstoffe deutlich effizienter herzustellen als zuvor. Wenn sich das Prinzip der wachstumsgekoppelten Produktion auf weitere Stoffwechselwege übertragen lässt, könnten Hersteller Arzneistoffe, Spezialfarbstoffe oder funktionale Biomaterialien mit geringerem Abfallaufkommen und reduzierten CO2‑Emissionen produzieren. Dies entspricht dem größeren Ziel nachhaltiger Bioprozesse in der industriellen Biotechnologie.
Für die Cephalopodenforschung beseitigt die verlässliche Verfügbarkeit von Xanthommatin einen bedeutenden experimentellen Flaschenhals. Forschende können kontrollierte Studien zur Hautoptik durchführen, untersuchen, wie Pigmente mit strukturellen Farbkomponenten wie Iridophoren zusammenwirken, und Prototypen für Materialien bauen, die schnelle Farbwechsel nachahmen. Solche biomimetischen Ansätze könnten sowohl militärische als auch zivile Anwendungen inspirieren — von adaptiven Oberflächen für Tarnung bis hin zu energieeffizienten, stimuliell veränderbaren Dekor- oder Sicherheitssystemen.
Auf technologischer Ebene besteht der nächste Fokus in mehreren Bereichen: Erstens die weitere Optimierung des mikrobiellen Wirts, etwa durch gezielte Knockouts von Nebenwegen, Overexpression limitierender Enzyme oder die Feinabstimmung des Redoxzustands und Cofaktorhaushalts. Zweitens ist Prozessentwicklung nötig — Steuerung von pH, Sauerstofftransport, Nährstoffzufuhr und Zellkulturbedingungen in größeren Bioreaktoren, um die Produktivität stabil zu halten. Drittens erfordert die Marktreife effiziente Aufreinigungsverfahren, die Pigment von Zellmaterial, Nebenprodukten und Mediumsbestandteilen trennen, ohne ökologische Nachteile zu erzeugen.
Von der wissenschaftlichen Neugier getriebene Momente der Serendipität spielen weiterhin eine Rolle: Bushin erinnerte sich daran, eine Kultur anzusetzen und am nächsten Morgen eine kräftige Pigmentbildung vorzufinden. "Es war einer meiner besten Tage im Labor", sagte sie — ein Hinweis darauf, dass kreatives Design und geduldige Experimentierfreude weiterhin überraschende Wege aufzeigen, wie biologische Systeme nutzbar gemacht werden können. Solche unerwarteten Beobachtungen liefern nicht nur emotionale Bestätigung, sondern können auch neue Hypothesen generieren, die zu technischen Verbesserungen führen.
Quelle: sciencealert


Kommentar hinterlassen