8 Minuten
Wissenschaftler experimentieren mit gentechnisch veränderten Bakterien, die gezielt Tumoren aufsuchen und attackieren — eine kühne Idee, die das Potenzial hat, die Krebstherapie von festen Tabletten zu adaptiven, lebenden Therapien zu transformieren. Frühe Studien am Menschen zeigen ermutigende Signale, doch Fragen zu Sicherheit, Dosisfindung und Eindämmung (Biokontainment) bleiben kritisch, bevor diese „lebenden Medikamente“ in die routinemäßige klinische Anwendung gelangen können. Dieser Artikel beschreibt die biologischen Grundlagen, technische Ansätze, regulatorische Aspekte und potenzielle klinische Einsatzmöglichkeiten von bakteriellen Onkotherapien.
Warum Bakterien? Ein neuer Krebstherapie-Ansatz
Bestimmte Bakterien neigen dazu, in sauerstoffarmen, nährstoffarmen Arealen innerhalb von soliden Tumoren zu überleben und sich anzusiedeln. Tumoren schaffen oft eine hypoxische Tumormikroumgebung mit eingeschränkter Durchblutung, in der viele systemisch verabreichte Therapeutika schlechter wirken. Genau dort können Mikroorganismen eine Nische finden: Manche Spezies sind natürlicherweise auf solche Bedingungen angepasst und vermehren sich bevorzugt im Tumor. Bioingenieure nutzen dieses Verhalten, indem sie Mikroben so umbauen, dass sie therapeutische Wirkstoffe freisetzen, das Immunsystem stimulieren oder Informationen über den Tumorzustand signalisieren.
Die Bandbreite möglicher Mechanismen ist groß. Bakterien können direkt zytotoxische Wirkstoffe oder Enzyme produzieren, die inaktivierte Prodrugs vor Ort in aktive Krebsmedikamente umwandeln. Alternativ können sie Immunmodulatoren wie Zytokine, Chemokine oder STING-Agonisten ausschütten, die lokale Immunantworten ankurbeln und Tumoren für T‑Zellen und körpereigene Effektorzellen sichtbarer machen. Andere Ansätze nutzen Bakterien als Biosensoren, die mithilfe synthetischer Signalwege auf Tumormarker reagieren und dann messbare Signale (z. B. fluoreszierende Proteine oder sekretierte Moleküle) abgeben — nützlich für Diagnostik und Therapieüberwachung.
Man kann sich diese Strategie als mikroskopischen Kurier vorstellen, der sich am Krankheitsherd vermehrt, seinen Wirkstoff lokal abgibt und seine Aktivität an die Gegebenheiten vor Ort anpasst. Diese Eigenschaft unterscheidet bakterielle Therapien von traditionellen, statischen Arzneimittelformen: Sie sind potenziell selbstvermehrend, ortsgebunden und programmierbar.
Wichtige Zielbakterien in der Forschung sind u. a. attenuierte Salmonella-Stämme, Clostridien, Bifidobacterium und bestimmte Escherichia‑coli‑Stämme (z. B. E. coli Nissle), weil sie in Tiermodellen Tumoren kolonisieren können oder sich sicher manipulieren lassen. Die Wahl des mikrobiellen Wirts hängt von Zieltumor, gewünschten Effekten und Sicherheitsanforderungen ab.
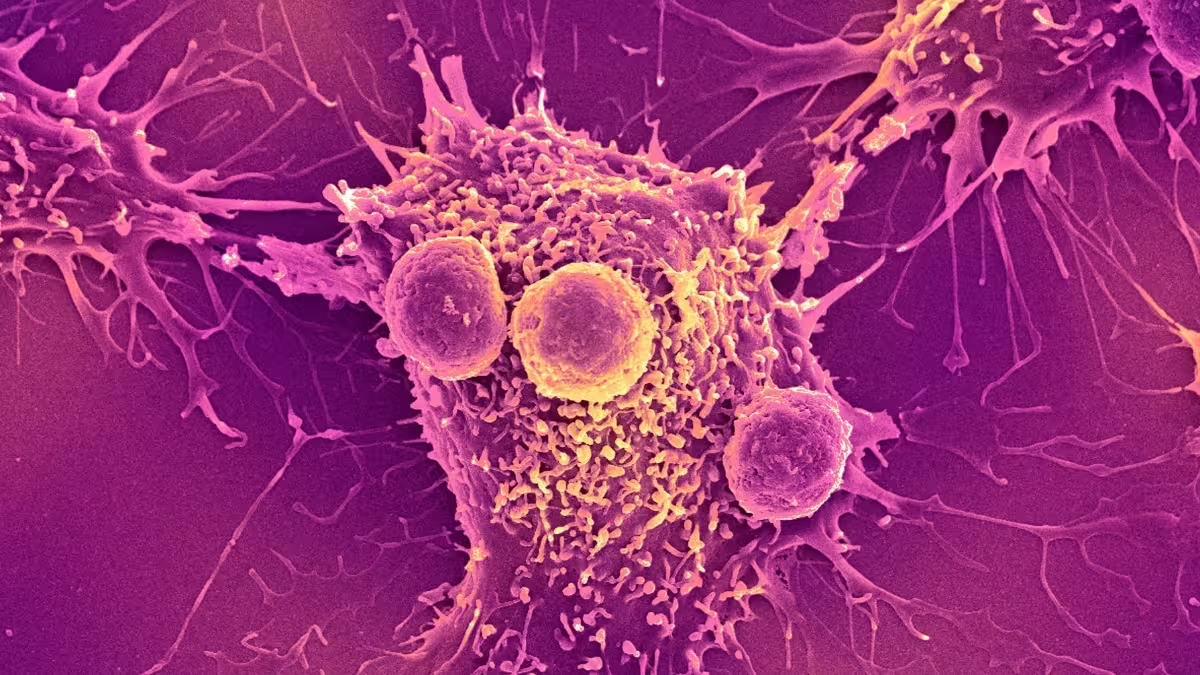
Aus Forschungssicht bietet die Bakterientherapie mehrere attraktive Vorteile für Onkologie, Immuntherapie und personalisierte Medizin:
- Lokalisierte Wirkstofffreisetzung reduziert systemische Toxizität.
- Multimodale Angriffsstrategien: direkte Zytotoxizität + Immunmodulation.
- Programmierbarkeit durch synthetische Biologie erlaubt bedarfsgesteuerte Aktivierung.
- Mögliche Kombination mit Checkpoint-Inhibitoren oder CAR‑T‑Zelltherapien zur Synergie.
Gleichzeitig sind die biologischen Variablen vielfältig: Tumorheterogenität, immunologische Breite des Patienten, Wechselwirkungen mit dem Mikrobiom und das Evolutionspotenzial der Bakterien im Wirtsorganismus erfordern differenzierte Designs und umfassende präklinische Validierung.
Sicherheit zuerst: Dosis, Infektionsrisiko und Immunreaktion
Frühe Phase‑I‑Studien legen nahe, dass bakterielle Onkotherapien in bestimmten Dosen tolerierbar sein können, doch die Dosisfindung ist ein empfindliches Gleichgewicht. Zu geringe Mengen führen zu ineffektiver Therapie, während zu hohe Mengen das Risiko unkontrollierter Infektionen oder übermäßiger Entzündungsreaktionen erhöhen. Kritische Sicherheitsfragen sind:
- DOSIERUNG UND PHARMAKOLOGIE: Wie viele Kolonien werden benötigt, um eine therapeutisch relevante lokale Konzentration von Wirkstoffen zu erreichen, ohne systemische Komplikationen zu provozieren? Die Verteilung, Persistenz und Clearance der Bakterien im Körper müssen modelliert werden.
- IMMUNREAKTION: Das Immunsystem kann die Bakterien rasch eliminieren oder eine überschießende Zytokinfreisetzung (ähnlich einem Zytokinsturm) auslösen. Beides beeinflusst Wirksamkeit und Sicherheit.
- EVOLUTIONSRISIKO: Selbst abgeschwächte Stämme können innerhalb des Wirts mutieren oder Genfunktionen austauschen. Monitoring und genetische Robustheit sind deshalb zentral.
- KONTROLLIERBARKEIT: Kliniker müssen in der Lage sein, die bakterielle Population bei Bedarf zu reduzieren oder zu beseitigen — z. B. durch selektive Antibiotika oder induzierbare Kill-Switches.
Aus klinischer Sicht werden deshalb mehrstufige Sicherheitsmaßnahmen empfohlen: startende Low‑Dose‑Akkumulation mit engmaschiger Überwachung, biomarkerbasierte Endpunkte (z. B. CRP, Leukozyten, Zytokinprofile), sowie vordefinierte Interventionsalgorithmen bei unerwünschten Ereignissen. Erfahrungen aus früheren Versuchen mit onkolytischen Viren und attenuierten bakteriellen Stämmen (z. B. historische Studien mit Salmonella VNP20009) liefern Daten zur Toxizität und sind hilfreich für das Design neuer Studien.
Wesentlich ist auch die Patientenauswahl: immunsupprimierte Patienten oder Personen mit vorher bestehenden Infektionen benötigen besondere Vorsicht. Darüber hinaus müssen Studienprotokolle Maßnahmen zur Vermeidung nosokomialer Übertragung und Umweltkontamination beinhalten.
Biokontainment: ingenieurbiologische Schutzmechanismen zur Risikobegrenzung
Biokontainment ist eine Kernanforderung für alle Ansätze mit lebenden Arzneimitteln. Forschende entwickeln eine Reihe von genetischen und systemischen Sicherheitsmechanismen, um Wachstum, Persistenz und Übertragung der Bakterien einzuschränken. Wichtige Strategien sind:
- Induzierbare Kill‑Switches: Gene, die bei Anwesenheit eines externen Triggers (z. B. eines kleinen Moleküls) die bakterielle Überlebensfähigkeit beseitigen.
- Auxotrophien: Genetische Abhängigkeit von nichtnatürlichen Nährstoffen oder synthetischen Aminosäuren, die nur in kontrollierten Produktions- oder Therapiesettings verfügbar sind.
- Quorum‑sensing‑gesteuerte Lysis: Populationen werden so programmiert, dass ab einer bestimmten Dichte eine programmierte Zelllyse eintritt.
- CRISPR‑basierte Safeguards: Zielgerichtete Genabschaltungen, die Mutationen korrigieren oder unerwünschte Gene entfernen.
- Redundanz und isolierende Designs: Kombination mehrerer unabhängiger Sicherheitsmodule reduziert die Wahrscheinlichkeit des Systemversagens durch einzelne Mutationen.
Neben genetischen Mitteln spielt die Prozesskontrolle eine große Rolle: GMP-konforme Herstellung, validierte Sterilisationsschritte und Rückverfolgbarkeit reduzieren das Risiko, dass kontaminierte Proben in die Umwelt gelangen. Zusätzlich werden in Studien häufig erlaubte Notfall‑Antibiotika definiert, mit denen Bakterien bei Bedarf eliminiert werden können. Dennoch kann Antibiotikaverwendung Nebenfolgen haben, z. B. Resistenzselektion, weshalb die Wahl antibiotikaselektiver Rückrufe sorgfältig abgewogen werden muss.
Forschung zur Minimierung horizontaler Genübertragung ist ebenfalls aktiv: Vermeidung mobiler genetischer Elemente, Verwendung stabiler Chromosomenintegrationen statt Plasmide und zusätzliche Barrieren gegen Rekombination sind gängige Maßnahmen. Insgesamt zielt Biokontainment darauf ab, die Wahrscheinlichkeit der Ausbreitung zu minimieren und bei unerwünschten Ereignissen schnell eingreifen zu können.
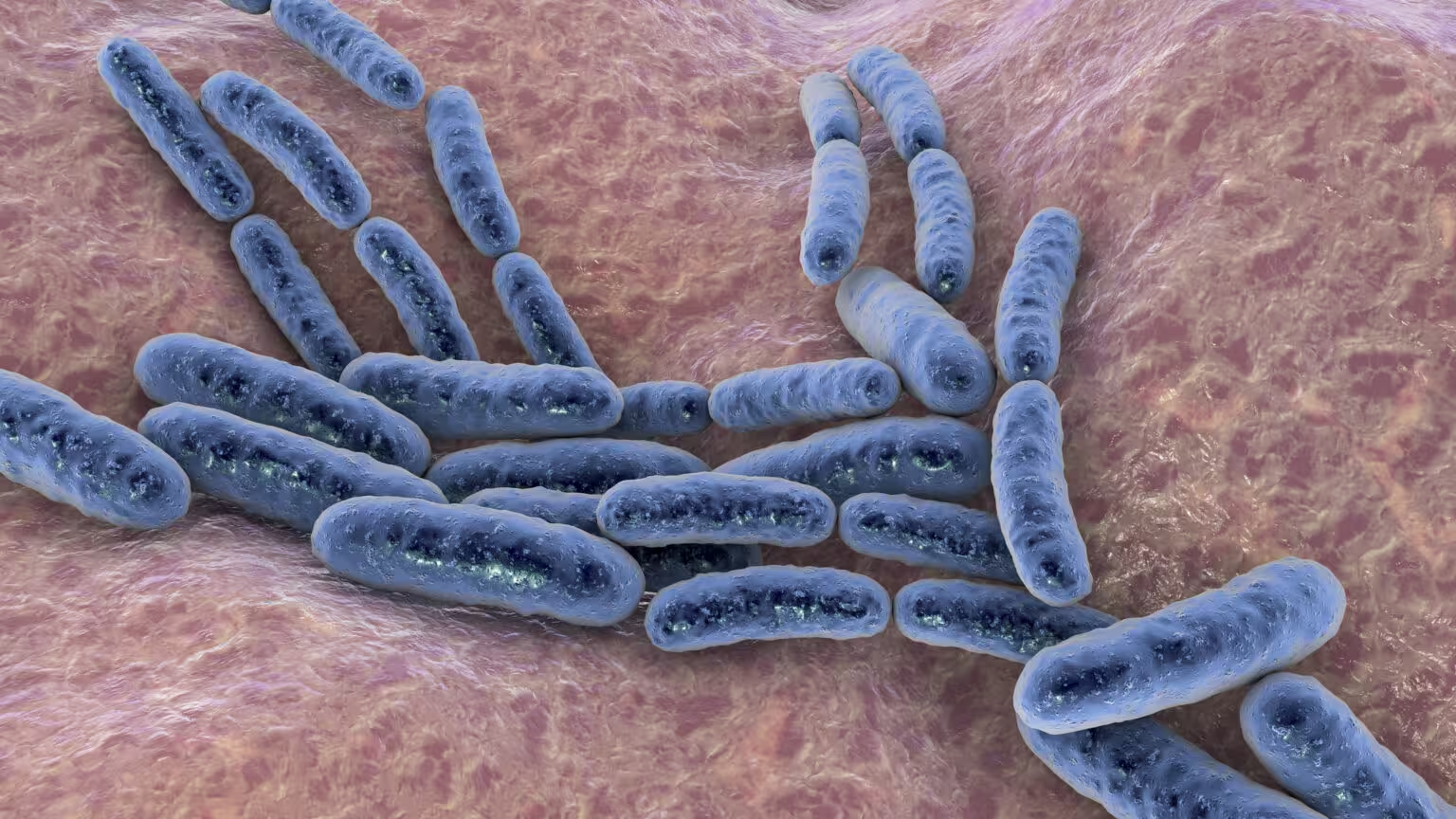
Neben genetischen Schutzsystemen werden auch physische und organisatorische Barrieren implementiert: isolierte Verabreichungsräume, spezielle Abfallentsorgung, Mitarbeiterschulungen und Patientenaufklärung zur häuslichen Vorsorge gehören dazu. Für die Zulassung solcher Therapien sind Protokolle verpflichtend, die sowohl patienten- als auch umweltbezogene Risiken adressieren.
Der regulatorische Weg und zukünftige Perspektiven
Über Laborerfolge hinaus müssen „lebende Medikamente“ strenge klinische Prüfungen und regulatorische Bewertungen durchlaufen. Behörden wie die Europäische Arzneimittelagentur (EMA) und die US Food and Drug Administration (FDA) haben Rahmenwerke für fortschrittliche Therapieprodukte entwickelt, doch bakterielle Onkotherapien stellen spezielle Anforderungen an Sicherheitsdaten, Herstellungsqualität und Umweltverträglichkeitsprüfungen.
Regulatorische Schwerpunkte umfassen u. a.:
- Umfassende präklinische Daten zu Toxizität, Biodistribution und genetischer Stabilität.
- GMP‑konforme Produktion mit Validierung genetischer Konstrukte und Abwesenheit von kontaminierenden Pathogenen.
- Ausführliche Risikoanalysen für Patientensicherheit und Umwelteinflüsse, einschließlich Worst‑Case‑Szenarien für Freisetzung und Evolution.
- Post‑Market‑Surveillance‑Pläne und Meldepflichten für unerwünschte Ereignisse.
Wenn diese Barrieren überwunden werden, könnte sich ein grundlegender Paradigmenwechsel abzeichnen: weg von statischen Wirkstoffdosen hin zu adaptiven biologischen Systemen, die sich dynamisch an die Tumordynamik anpassen. Solche Therapien versprechen gezieltere, potenziell effektivere Krebsbehandlungen, besonders bei Tumoren, die auf Standardtherapien schlecht ansprechen. Beispiele für mögliche Zukunftsszenarien:
- Personalisierte bakterielle Therapeutika, die anhand des individuellen Tumorprofils programmiert werden.
- Kombinationen mit Immuncheckpoint‑Inhibitoren oder CAR‑T‑Zelltherapien zur Verstärkung der Immunantwort.
- Entwicklung standardisierter Biokontainment‑Plattformen für mehrere Klassen lebender Medikamente.
Allerdings sind auch ethische, ökonomische und logistische Fragen zu klären: Wer trägt die Verantwortung für Langzeitfolgen? Wie werden Kosten und Zugang zu solchen teuren, hochindividualisierten Therapien geregelt? Wie lassen sich Herstellung und Lagerung von lebenden Arzneimitteln in breiter klinischer Nutzung skalieren? Die Antworten erfordern interdisziplinäre Kooperationen zwischen Wissenschaft, Klinik, Regulatorik, Ethik und Industrie.
Fazit: Bakterielle Onkotherapien kombinieren die Fortschritte synthetischer Biologie, Immunologie und Onkologie und bieten neue Optionen für hartnäckige Tumoren. Ihre Zukunft hängt jedoch davon ab, ob Forscher robuste Sicherheitsmechanismen, zuverlässige Dosisstrategien und klare regulatorische Pfade etablieren können. Mit sorgfältiger Entwicklung, transparenten Studien und engem Monitoring könnten „lebende Medikamente“ künftig einen wichtigen Platz in der Krebsbehandlung einnehmen.
Quelle: sciencealert

Kommentar hinterlassen