6 Minuten
Forscher in Spanien haben eine kleine Gruppe von Neuronen in der Amygdala identifiziert, die Angst‑ähnliches Verhalten bei Mäusen auslösen — und durch Wiederherstellung des Gleichgewichts auch umkehren können. Indem das Team gezielt das Gen GRIK4 und sein Proteinprodukt GluK4 ansprach, stellten sie normales Sozialverhalten wieder her und verringerten depressive Merkmale bei Tieren, die für erhöhte Angst gezüchtet wurden. Dieser präzise Ansatz eröffnet konkrete Perspektiven für zukünftige Therapien gegen Angststörungen und verwandte affektive Erkrankungen.
Wie wenige Zellen das emotionale Gleichgewicht verändern
Die von Consejo Superior de Investigaciones Científicas (CSIC) und der Universidad Miguel Hernández de Elche (UMH) geleitete Studie, veröffentlicht in iScience (2025), konzentrierte sich auf die basolaterale Amygdala (BLA) — eine zentrale Hirnregion für Furcht, Entscheidungsfindung und emotionale Erinnerung. Anstatt großflächige Veränderungen im gesamten Gehirn zu untersuchen, verfolgten die Forschenden die Aktivität einer spezifischen neuronalen Population innerhalb der BLA. Diese fokussierte Herangehensweise zeigte, dass ein Ungleichgewicht in genau dieser Population ausreicht, um pathologische Angstzustände und soziale Defizite hervorzurufen.
Bei Überexpression des GRIK4‑Gens stieg die Produktion des GluK4‑Proteins deutlich an. Die betroffenen Mäuse zeigten typisches Vermeidungsverhalten: Sie mieden offene Bereiche, zogen sich sozial zurück und entwickelten depressive Verhaltensweisen, die in Standardtests gemessen wurden. Zusätzlich hatten die Tiere Schwierigkeiten bei Objekt‑Erkennungsaufgaben, was darauf hinweist, dass die gestörte Aktivität nicht nur lokale Effekte in der BLA verursacht, sondern auch über verbundene neuronale Schaltkreise hinausreichende kognitive Konsequenzen haben kann. Diese Beobachtungen unterstreichen die Bedeutung der basolateralen Amygdala als Knotenpunkt in Netzwerken, die Angst, Sozialverhalten und Gedächtnisprozesse integrieren.
Gen‑Editing beruhigt ängstliche Gehirne bei Mäusen
Um die beobachteten Verhaltensstörungen zu korrigieren, setzten die Forschenden zielgerichtete Werkzeuge zur Genbearbeitung ein, um überschüssige Kopien von GRIK4 in der BLA zu entfernen und so die GluK4‑Spiegel zu senken. Das Ergebnis war auffallend: Angst‑ähnliche Reaktionen und soziale Defizite verschwanden; die behandelten Mäuse kehrten zu typischeren Explorations‑ und Interaktionsmustern zurück. Der Neurowissenschaftler Álvaro García kommentierte: „Diese einfache Anpassung reichte aus, um angstbezogene und soziale Defizit‑Verhaltensweisen umzukehren — das ist bemerkenswert.“
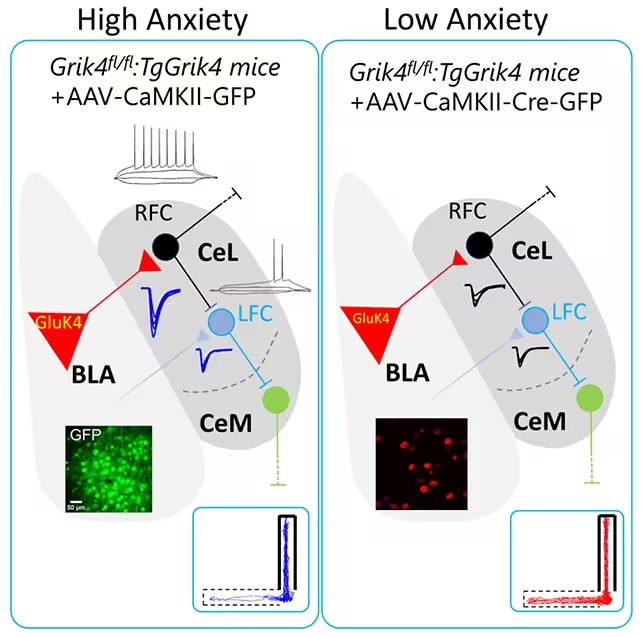
Wichtig ist, dass dieselbe Intervention auch bei nicht genetisch veränderten Mäusen wirksam war, die von Natur aus eine höhere Ängstlichkeit zeigten. Dies demonstriert, dass der Ansatz über zielgerichtete Genmanipulation in transgenen Modellen hinaus auch bei natürlichen Variationen des Verhaltens Greifbares leisten kann. Allerdings blieben Defizite in der Objekt‑Erkennung bei den behandelten Tieren bestehen, was darauf hindeutet, dass manche kognitiven Folgen von Angstzuständen auf andere Hirnregionen oder vernetzte Systeme zurückzuführen sind, die von der lokalen Behandlung der BLA nicht erfasst wurden. Solche Befunde weisen auf die Notwendigkeit hin, neuronale Schaltkreise umfassender zu kartieren und zu verstehen, wie lokale Eingriffe systemweite Funktionen beeinflussen.
Warum das wichtig ist — und was noch offen bleibt
Die Identifikation einer klar abgegrenzten neuronalen Population, deren Aktivität allein pathologische Angst auslösen kann, verändert die Perspektive auf die Behandlung affektiver Störungen. Anstatt breit wirkender Psychopharmaka, die das gesamte Gehirn beeinflussen und oft unerwünschte Nebenwirkungen hervorrufen, eröffnet das gezielte Ansteuern diskreter Schaltkreise die Aussicht auf lokalisierte Therapien mit potenziell besserer Verträglichkeit und Wirksamkeit. Solche interventionsorientierten Strategien zielen direkt auf molekulare Treiber wie GRIK4/GluK4 oder auf die Aktivitätsmuster spezifischer Neuronengruppen ab.
Gleichzeitig bleibt die Übertragbarkeit dieser Ergebnisse auf den Menschen spekulativ. Mausmodelle sind wertvolle präklinische Werkzeuge, doch das menschliche Gehirn ist in Struktur, Größenskala und funktionaler Vernetzung deutlich komplexer. „Wir wussten bereits, dass die Amygdala an Angst und Furcht beteiligt ist, doch jetzt haben wir eine spezifische Neuronenpopulation identifiziert, deren unausgeglichenes Aktivitätsmuster allein ausreicht, pathologisches Verhalten auszulösen“, erklärte Juan Merma, Co‑Autor der Studie. Ein weiterer Forscher, Lerma, hob hervor, dass das gezielte Ansteuern dieser Schaltkreise zu einer ‚effektiven und stärker lokalisierten Strategie zur Behandlung affektiver Störungen‘ werden könnte. Dennoch sind klinische Anwendungen mit technologischen, ethischen und sicherheitsrelevanten Hürden verbunden, die sorgfältig adressiert werden müssen.
Zukünftige Richtungen und therapeutische Perspektiven
Die nächsten Schritte umfassen das systematische Mapping, wie eine Dysregulation von GluK4 verbundene Schaltkreise außerhalb der BLA verändert, sowie die Entwicklung und Prüfung sicherer Liefermethoden, mit denen GRIK4 in größeren Tiermodellen moduliert werden kann. Dazu gehören präzise Methoden der Genmodulation und Neuroscience‑Technologien, etwa CRISPR‑basierte Editierung (unter strenger Kontrolle und Validierung), virale Vektoren für gezielte Genübertragung oder RNA‑basierte Ansätze zur temporären Regulation der Genexpression. Ebenso denkbar sind pharmakologische Strategien, die sich selektiv an Kainat‑Rezeptoren mit GluK4‑Untereinheiten richten, um die neuronale Erregbarkeit ohne dauerhafte genetische Veränderungen zu modulieren.
Methoden, die eine regionenspezifische Modulation ermöglichen — etwa stereotaktische Lokalapplikation, gezielte Freisetzungssysteme oder weiterentwickelte Vektortechnologien mit eingeschränkter Tropismus — könnten die Translation in größere Tiermodelle und schließlich in frühe klinische Studien erleichtern. Wichtige Ziele sind dabei nicht nur Wirksamkeit und Spezifität, sondern auch Sicherheit, Reversibilität und die Minimierung immunologischer Reaktionen auf Vektoren oder editierende Enzyme.
Vorläufig bietet die Studie ein klareres mechanistisches Bild: Kleine neuronale Ungleichgewichte in der Amygdala können überproportional starke emotionale Effekte erzeugen, und die Korrektur dieser Ungleichgewichte kann viele, jedoch nicht alle Symptome umkehren. Diese Unterscheidung ist entscheidend für die weitere Grundlagenforschung und die Entwicklung next‑generation Therapien gegen Angststörungen. Insbesondere legt sie nahe, dass kombinierte Ansätze — lokale Genmodulation in Verbindung mit neuromodulatorischen oder verhaltenstherapeutischen Interventionen — am erfolgversprechendsten sein könnten, um sowohl emotionale Symptome als auch kognitive Begleitstörungen umfassend zu behandeln.
Aus wissenschaftlicher Sicht stärkt die Arbeit die Bedeutung von präzisen, netzwerkbezogenen Konzepten in der Psychiatrie und Neurowissenschaft: Anstatt Symptome isoliert zu betrachten, rückt sie die funktionale Rolle einzelner neuronaler Populationen in übergeordneten Schaltkreisen in den Mittelpunkt. Für klinische Übersetzungen bedeutet das, dass Biomarker für die betroffenen Schaltkreise, nicht nur für globale Botenstoffe oder allgemeine Symptome, entwickelt werden müssen. Solche Biomarker könnten molekulare Signaturen (etwa veränderte GRIK4‑Expression), bildgebende Kennwerte oder elektrophysiologische Muster umfassen, die gezielte Interventionen ermöglichen und deren Wirkung messbar machen.
Insgesamt bietet die Studie einen wichtigen Schritt zur Präzisionsbehandlung von Angststörungen: Sie identifiziert ein konkretes molekulares Ziel (GRIK4/GluK4) in einer klar abgegrenzten neuronalen Population (BLA), demonstriert die Wirksamkeit eines gezielten Eingriffs in Tiermodellen und zeigt gleichzeitig die Grenzen einer rein lokalen Therapie. Diese Erkenntnisse sind nützlich für Forschende, die an neuronalen Schaltkreisen, Genmodulation, Pharmakologie und klinischer Translation arbeiten, und bilden eine Basis für interdisziplinäre Projekte zur Entwicklung sichererer, punktgenauer Therapien gegen Angst und affektive Störungen.
Quelle: sciencealert

Kommentar hinterlassen