8 Minuten
Stellen Sie sich eine kontraintuitive Wendung in der Krebsbiologie vor: sehr alte Tiere zeigen weniger Krebs statt mehr. Neue Forschungsergebnisse der Stanford University zeigen, dass Mäuse im fortgeschrittenen Alter weniger und kleinere Lungentumoren entwickeln als jüngere Tiere mit denselben krebsauslösenden Mutationen. Die Resultate stellen die einfache Annahme infrage, dass das Krebsrisiko mit der Zeit zwangsläufig und ungebremst ansteigt, und deuten auf altersbedingte Veränderungen hin, die paradoxerweise die Tumorentstehung unterdrücken könnten.
Die Forschenden hinter der Studie sehen in den Befunden eine mögliche Erklärung für ein lange beobachtetes menschliches Muster: Die Krebsinzidenz steigt bis ins mittlere und späte Erwachsenenalter an, flacht aber bei sehr alten Menschen häufig ab oder nimmt sogar ab. Das Stanford-Team arbeitete mit genetisch veränderten Mäusen und umfassenden molekularen Analysen, um zu ergründen, welche Aspekte des Alterns das Tumorwachstum dämpfen könnten und wie bestimmte Treibermutationen im Lebensverlauf unterschiedlich wirken.
Ein überraschendes Muster bei alten Mäusen: weniger, kleinere Lungentumoren
Die Forschergruppe verglich die Tumorbildung in zwei Alterskohorten von Labormäusen: "jung" erwachsene Tiere (vier bis sechs Monate alt) sowie Tiere im fortgeschrittenen Alter (20 bis 21 Monate, was ungefähr dem menschlichen Pendant sehr hohen Alters entspricht). Um Lungenkrebs auszulösen, nutzten die Wissenschaftler ein gezieltes, inhalatives Genübertragungssystem, das fluoreszierend markierte Tumoren erzeugt und so präzise Bildgebung und Quantifizierung erlaubt.
Nach Induktion des Krebses und einer Wartezeit von 15 Wochen war der Unterschied deutlich. Junge Mäuse entwickelten in etwa das Dreifache an Tumorlast, gemessen an Lungengewicht und fluoreszierender Fläche, und hatten etwa dreimal so viele einzelne Tumoren. Die Tumoren bei den jüngeren Tieren waren zudem größer und wuchsen schneller. Kurz gesagt: Nach allen verwendeten Messgrößen zeigten jüngere Mäuse eine aggressivere Krankheitsausprägung.
Diese Ergebnisse spiegeln epidemiologische Beobachtungen beim Menschen wider: Die Krebsraten steigen bis ins mittlere und späte Lebensalter an, flachen aber häufig oder fallen nach etwa dem 85. Lebensjahr ab. Bislang wurde debattiert, ob dieser Rückgang durch weniger Screenings und Unterdiagnostik bei sehr alten Menschen bedingt ist oder ob biologische Faktoren die Tumorentstehung reduzieren. Die neuen Mäusedaten deuten auf einen echten, altersgebundenen biologischen Effekt hin, der Tumorinitiation und -wachstum unterdrückt.
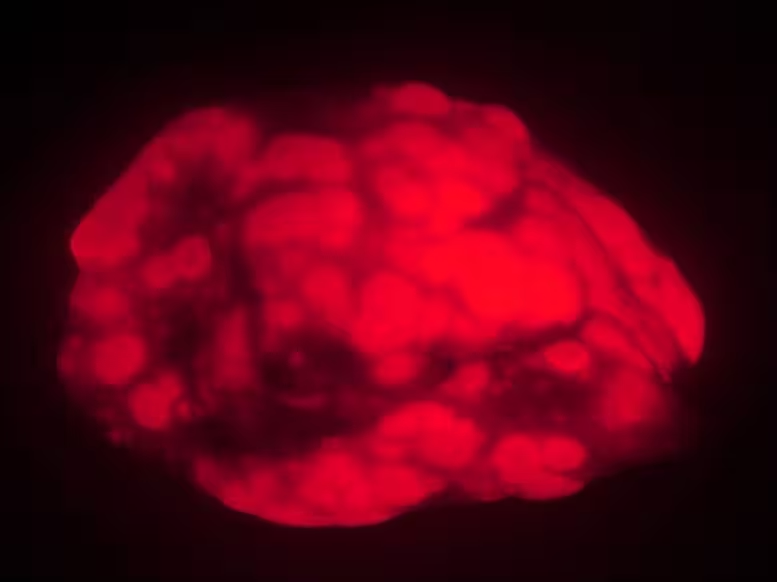
Alte Mäuse entwickeln in diesem Krebsmodell weniger und kleinere Lungentumoren (rot) als jüngere Tiere. Die Befunde legen nahe, dass bei sehr alten Tieren oder Menschen der Alterungsprozess die Tumorbildung hemmt.
Welche Änderungen im Alter könnten Krebs blockieren?
Auf den ersten Blick scheint Altern Krebs zu begünstigen: Jede Zellteilung birgt das Risiko für DNA-Schäden, und viele Altersmerkmale – genomische Instabilität, veränderte DNA-Methylierungsmuster und mitochondriale DNA-Umstrukturierungen – erscheinen wie günstiger Nährboden für maligne Transformationen. Über große Teile des Erwachsenenlebens korreliert diese Anhäufung von Schäden tatsächlich mit einer steigenden Krebsinzidenz.
Dennoch argumentiert das Stanford-Team, dass einige altersassoziierte Veränderungen für Neoplasien zunehmend feindlich werden können. In der Studie untersuchten die Forschenden, wie die Inaktivierung einer Gruppe von 25 bekannten Tumorsuppressorgenen die Tumorbildung in jungen gegenüber alten Mäusen beeinflusst. Tumorsuppressoren sind Gene, deren Produkte normalerweise unkontrolliertes Zellwachstum bremsen; wenn diese Gene verloren gehen oder deaktiviert werden, entstehen Tumoren leichter.
Obwohl das Abschalten vieler Tumorsuppressoren die Tumorlast in beiden Altersgruppen erhöhte, war das Ausmaß dieses Effekts nahezu durchgängig in jungen Mäusen größer. Anders formuliert: Derselbe genetische Schlag führte in der Jugend zu einem deutlich stärkeren Krankheitsbild. Ein Gen stach besonders hervor: PTEN. Die Inaktivierung von PTEN hatte einen deutlich stärkeren tumorfördernden Effekt bei jungen Tieren als bei alten, was darauf hinweist, dass der biologische Kontext eines gealterten Gewebes die Funktionsweise eines zentralen Krebswegs verändert.
Um Mechanismen zu untersuchen, sequenzierten die Forschenden die Genexpressionsmuster in Krebszellen aus alten versus jungen Mäusen sowie aus Tumoren mit und ohne PTEN. Unerwartet zeigte sich, dass sogar schnell teilende Krebszellen aus alten Tieren molekulare Signaturen beibehielten, die mit Alterung assoziiert sind. Diese alterungsbezogenen Transkriptionsmuster wurden abgeschwächt, wenn PTEN inaktiviert war, und PTEN-defiziente Krebszellen in alten Mäusen ähnelten im Expressionsprofil jenen junger Tumoren – ein faszinierendes Indiz dafür, dass bestimmte Alterungsmerkmale beim Verlust zentraler Signalwege überlagert oder rückgängig gemacht werden können.
Eine kurze Anmerkung zum technischen Kontext
Die Studie nutzte fluoreszente Markierung zur Quantifizierung der Tumorlast, kontrollierte Werkzeuge zur Geninaktivierung, um Effekte von Tumorsuppressoren zu testen, sowie RNA-Profiling, um zu untersuchen, wie Alterungssignaturen in transformierten Zellen persistieren. Das experimentelle Design erforderte einen langen Zeitrahmen – die Forschenden warteten beinahe zwei Jahre, bis Mäuse fortgeschrittenes Alter erreichten –, was verdeutlicht, warum Alterungseffekte experimentell schwer zu untersuchen sind. Solche langlaufenden Präklinischen Modelle sind jedoch essenziell, um altersabhängige Tumorbiologie realistisch abzubilden.
Warum die Befunde für Krebsforschung und Therapie wichtig sind
Die praktischen Schlussfolgerungen sind weitreichend. Erstens erfassen gängige Krebsmodelle – die häufig auf jungen erwachsenen Mäusen basieren – möglicherweise nicht die entscheidende altersabhängige Biologie. Das kann präklinische Tests gezielter Therapien verzerren, weil Wirkstoffe in älteren Geweben anders agieren könnten, dort wo sich die molekulare Landschaft verändert hat.
Zweitens legt die Studie nahe, dass Altern nicht generell tumorfördernd ist. Bestimmte Aspekte des gealterten Mikro- oder Zellmilieus sowie zell-intrinsische Veränderungen können die Tumorinitiation hemmen oder das Fortschreiten verlangsamen. Das Verständnis dieser schützenden Mechanismen könnte neue therapeutische Ansätze eröffnen: Wenn Altern Gewebe so umbaut, dass es Krebs widersteht, lässt sich diese "Verdrahtung" möglicherweise therapeutisch nachahmen oder modulieren.
Drittens warnt die unterschiedliche Wirkung der PTEN-Inaktivierung davor, dass spezifische Treibermutationen und zielgerichtete Therapien altersabhängig unterschiedlich wirken können. Precision Oncology ordnet Medikamente in der Regel Mutationsprofilen zu – der altersbedingte Kontext könnte jedoch die Potenz dieser Mutationen modulieren und damit die Wirksamkeit der darauf ausgerichteten Behandlungen beeinflussen.
Monte Winslow, Associate Professor für Genetik und Pathologie und einer der Seniorautoren der Studie, betont, dass die Ergebnisse ein Umdenken bei der Wahl von Modellen für translationale Forschung erfordern. Dmitri Petrov, ein weiterer Seniorautor, fasst die Befunde breiter zusammen: Altern könne unbekannte, potenziell nutzbare Vorteile bergen, die Forscherinnen und Forscher erlernen und gezielt nutzen könnten.
Experteneinschätzung
Dr. Lena Morales, eine fiktive Geroscience-Forscherin (University Center for Aging Biology), kommentiert: "Diese Daten unterstreichen, dass Altern kein linearer Abstieg ist. Manche zellulären Signalwege, die sich mit dem Alter verändern, schaffen Mikroumgebungen, die weniger aufnahmebereit für Tumorinitiation sind. Das bedeutet nicht, dass Altern insgesamt Schutz bietet – ältere Menschen leiden an erhöhter Gebrechlichkeit und anderen Erkrankungen – aber es eröffnet eine wertvolle Forschungsrichtung: Welche schützenden Eigenschaften gealterter Gewebe lassen sich isolieren und in Therapien übersetzen?"
Ihre Einschätzung hebt eine zentrale Forschungsaufgabe hervor: nützliches versus schädliches altersassoziiertes Umprogramming auseinanderzuhalten und zu bestimmen, welche Veränderungen sich pharmakologisch sicher nachbilden lassen. Dazu gehören Fragen nach Verträglichkeit, off-target-Effekten und Langzeitfolgen einer solchen Imitation von Alterungszuständen.
Breitere Implikationen und nächste Schritte
- Modellentwicklung: Labore sollten gealterte Tiere in präklinische Studien integrieren, um altersabhängige Effekte auf Tumorbiologie und Therapieansprechen zu erfassen. Dies betrifft sowohl genetische Mausmodelle als auch pharmakologische Interventionsstudien.
- Mechanistische Arbeit: Forschende müssen identifizieren, welche Alterungssignaturen – epigenetische Markierungen, metabolische Verschiebungen, Immunumgestaltung, Veränderungen der extrazellulären Matrix oder zelluläre Seneszenz und SASP (senescence-associated secretory phenotype) – maßgeblich zur Tumorsuppression in alten Geweben beitragen.
- Translation in die Klinik: Wenn altersgebundene Schutzmechanismen validiert werden, könnten daraus Wirkstoffkonzepte entstehen, die diese Zustände in jüngeren Patienten nachahmen oder Therapien bei älteren Patientengruppen verbessern, wobei physiologische Unterschiede altersgerecht berücksichtigt werden müssen.
Die Studie, angeführt von Erstautorin Emily Shuldiner und veröffentlicht am 4. November in Nature Aging, stellt eine der ersten kontrollierten Demonstrationen dar, dass Altern in einem Säugetiermodell aktiv die Tumorinitiation und -progression repressieren kann. Sie zeigt außerdem, dass altersrelevante molekulare Signaturen in sich teilenden Krebszellen fortbestehen können, was Annahmen darüber, wie "junge" Krebszellen auf Transcriptom-Ebene aussehen sollten, komplexer macht.
In der Summe rückt die Arbeit das Altern in der Krebsforschung in ein neues Licht: Statt Alter allein als Ansammlung von Schäden zu betrachten, sollten Wissenschaftlerinnen und Wissenschaftler Altern als komplexen, systemischen Umbau begreifen, der mitunter neue Beschränkungen für maligne Zellen schafft. Der systemische Blick auf altersabhängige Tumorbiologie könnte innovative Strategien für Prävention und Therapie hervorbringen, die an die Biologie unterschiedlicher Altersgruppen angepasst sind.
Quelle: scitechdaily

Kommentar hinterlassen