7 Minuten
Eine winzige, stressanfällige Population von Neuronen tief in der Hirnrinde könnte den Blutfluss und die elektrische Aktivität im gesamten Gehirn orchestrieren. Neue Experimente an Mäusen deuten darauf hin, dass diese seltenen Zellen — bekannt als Typ‑I nNOS‑Neuronen — eine überproportionale Rolle bei schlafbezogenen Gehirnrhythmen, der Reinigung des Gewebes und möglicherweise in frühen Stadien neurodegenerativer Erkrankungen spielen. Die Befunde verknüpfen neuronale Regulationsmechanismen mit vaskulärer Dynamik und werfen damit ein neues Licht auf Prozesse wie die Glymphatik, vaskuläre Dysfunktion und die frühen Risikofaktoren für Demenz.
Wie wenige Zellen das ganze Gehirn beeinflussen
Typ‑I nNOS‑Neuronen sind sehr spärlich und vorwiegend in den tiefen Schichten der Hirnrinde lokalisiert, doch scheinen sie weit mehr zu bewirken, als ihre Zahl vermuten lässt. Forscher der Pennsylvania State University setzten gezielte Methoden ein, um diesen Zelltyp bei Mäusen selektiv zu eliminieren, und überwachten anschließend Veränderungen im zerebralen Blutfluss, in den langsamen Gefäßpulsationen (Vasomotion) und in der allgemeinen neuronalen Aktivität. Durch diese gezielte Herangehensweise konnten die Studienautoren die spezifische Rolle dieser seltenen Neuronen isolieren, ohne großflächig umliegendes Gewebe zu schädigen.
Die Ergebnisse waren eindrücklich: Tiere ohne Typ‑I nNOS‑Neuronen zeigten deutlich reduzierten globalen Blutfluss, abgeschwächte Vasomotion und verringerte neuronale Feuerraten. Insbesondere langsame Delta‑Wellen — die Gehirnrhythmen, die mit Tiefschlaf und Gedächtniskonsolidierung verbunden sind — nahmen in ihrer Amplitude ab, und die übliche Synchronisation zwischen linker und rechter Hemisphäre war gestört. Solche Veränderungen deuten darauf hin, dass diese wenigen Zellen als Koordinatoren wirken, die vaskulären Zustand und Netzwerkaktivität koppeln und so die makroskopische Gehirndynamik beeinflussen.
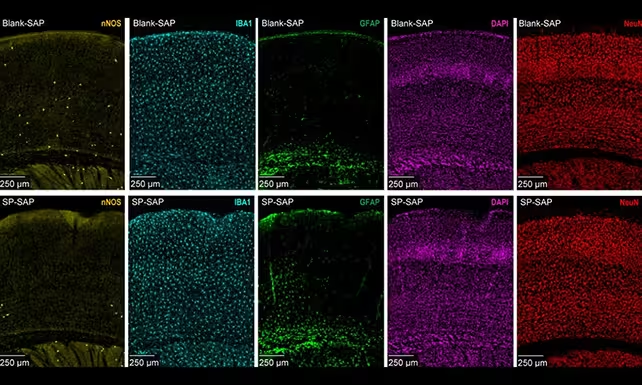
Typ‑I nNOS‑Neuronen (in Gelb) sind deutlich seltener als andere Zelltypen und wurden von den Forschern selektiv entfernt.
Warum Vasomotion und langsame Wellen wichtig sind
Vasomotion bezeichnet die spontane, rhythmische Erweiterung und Verengung von zerebralen Arterien, Venen und Kapillaren in Intervallen von wenigen Sekunden. Diese kontinuierliche Schwingung unterstützt die Bewegung von interstitieller Flüssigkeit und Liquor cerebrospinalis durch das Gehirngewebe und fördert damit die Entfernung metabolischer Abfallprodukte. Das Zusammenspiel von Vasomotion und neuronaler Aktivität trägt zur Funktion des glymphatischen Systems bei — einem Mechanismus, der Schlaf‑assoziierte Reinigungsvorgänge mit vaskulären Pulsationen verknüpft. Schwächt die Vasomotion ab, kann die Clearance toxischer Proteine, wie Amyloid‑β oder Tau‑Fragmente, beeinträchtigt werden — Faktoren, die bei Alzheimer und anderen neurodegenerativen Erkrankungen eine Rolle spielen.
Das Team der Penn State beobachtete, dass die Abnahme von Blutfluss und neuronaler Aktivität besonders ausgeprägt während des Schlafs war, wenn Delta‑Wellen normalerweise dominieren. Diese zeitliche Korrelation legt nahe, dass eine Beeinträchtigung der Typ‑I nNOS‑Neuronen sowohl die Schlafarchitektur als auch die nächtlichen Reinigungsprozesse des Gehirns stören könnte. Langfristig könnten solche Veränderungen die Anfälligkeit für kognitive Verschlechterung erhöhen, da gestörter Tiefschlaf und reduzierte Abfallbeseitigung kumulative Effekte haben, die neuronale Homöostase und Synapsengesundheit beeinträchtigen.
Experimentelle Details und mögliche Folgerungen
Die Forscher verwendeten zellselektive Ablationstechniken in Mäusen, um die Rolle der Typ‑I nNOS‑Neuronen zu isolieren, ohne umliegendes Gewebe großflächig zu zerstören. Solche Ansätze umfassen in der Regel genetische Werkzeuge (z. B. gezielte Cre‑/DTR‑Systeme), chemische oder optogenetische Methoden zur gezielten Hemmung beziehungsweise Eliminierung bestimmter Zellpopulationen. Nach der Ablation zeigte sich eine Verringerung der Amplitude spontaner vaskulärer Oszillationen und eine Abschwächung der langsamen Wellenaktivität im EEG. Die simultanen Änderungen in vaskulärer und neuronaler Dynamik deuten darauf hin, dass die betroffenen Neuronen als Hub fungieren, der die Blutversorgung in Zeit und Raum mit Netzwerkaktivität synchronisiert.
Der biomedizinische Ingenieur Patrick Drew, dessen Labor zuvor nNOS‑bezogene Blutflussregulation kartiert hat, beschreibt spontane Gefäßoszillation als einen rhythmischen Mechanismus des Gehirns, Flüssigkeit zu bewegen, indem Gefäße im Sekundentakt dilatieren und kontrahieren. Er und seine Kollegen argumentieren, dass der Verlust jener Neuronen, die solche Oszillationen timen und modulieren, eine Kaskade von Dysfunktionen auslösen könnte — mit Folgen für Schlafqualität, waste clearance und langfristige Gehirngesundheit. Technisch betrachtet verknüpfen nNOS‑Neurone die neuronale Freisetzung von Stickstoffmonoxid (NO) mit vaskulärer Tonusregulation; NO ist ein bekannter Vasodilatator und Modulator neuronaler Erregbarkeit, weshalb Störungen in diesem System weitreichende Effekte haben können.
Von Mäusen auf den Menschen: was ist plausibel?
Diese Ergebnisse stammen aus Mausmodellen, und die Übertragung auf das menschliche Gehirn erfordert weitere Forschung. Gleichwohl sind viele grundlegende vaskuläre und neuronale Prozesse über Säugetiere hinweg konserviert, sodass die Vorstellung, dass eine kleine, stress‑anfällige neuronale Population die Dynamik des gesamten Gehirns beeinflussen kann, plausibel erscheint. Sollte sich herausstellen, dass vergleichbare Zellen beim Menschen existieren und ähnlich funktionieren, könnte ihr Verlust durch chronischen Stress, Alterung oder entzündliche Prozesse ein bislang unterschätzter Treiber neurodegenerativer Entwicklungen sein.
Reduzierter zerebraler Blutfluss gilt bereits als ein Faktor, der zu kognitiven Einschränkungen und Demenz beiträgt. Die neuen Daten verfeinern dieses Bild, indem sie einen spezifischen Zelltyp identifizieren, der vaskulären Tonus, langsamen Schlaf und interhemisphärische Synchronität verbindet — Aspekte, die für die Aufrechterhaltung kognitiver Funktionen relevant sind. Aus klinischer Sicht eröffnet dies zusätzliche Ansatzpunkte für Diagnose und Monitoring: Bildgebende Verfahren, die Vasomotion, Perfusion oder langsame Wellen erfassen, könnten in Kombination Hinweise auf einen beginnenden Funktionsverlust dieser neuronalen Population liefern.
Was Forschende als Nächstes untersuchen werden
Zukünftige Experimente müssen klären, ob das menschliche Gehirn auf eine äquivalente Population von Typ‑I nNOS‑Neuronen angewiesen ist. Wissenschaftler werden außerdem untersuchen, wie Stress, chronische Entzündung oder Alterungsprozesse diese Zellen selektiv schädigen und ob ein Verlust dieser Neuronen messbare kognitive Symptome zeitlich vorausgeht. Methodisch könnten postmortale Gewebestudien, single‑cell RNA‑Sequencing, humane Stammzellmodelle sowie nichtinvasive Bildgebung zum Einsatz kommen, um homologe Zelltypen und ihre Funktion in Menschen zu identifizieren.
Falls die Verbindung bestätigt wird, könnten Strategien zum Schutz oder zur Wiederherstellung dieser neuronalen Kohorte als therapeutisches Ziel dienen. Mögliche Ansätze reichen von Lebensstil‑ und Stressmanagementinterventionen über pharmakologische Maßnahmen zur Gefäßprotektion und entzündungshemmende Therapien bis hin zu neuromodulatorischen Verfahren, die slow‑wave‑Schlaf verstärken (z. B. akustische Stimulation, transkranielle elektrische Stimulation) oder die NO‑Signalgebung gezielt beeinflussen. Zelltherapien oder zielgerichtete Neuroprotektion könnten langfristig ebenfalls relevant werden, sind aber derzeit spekulativ und bedürfen umfangreicher präklinischer sowie klinischer Prüfung.
Expertise und Einordnung
Dr. Claire Mendoza, eine nicht an der Studie beteiligte Neurovaskularforscherin, kommentiert: »Die Vorstellung, dass ein seltener Zelltyp vaskuläre Rhythmen im gesamten Gehirn koordinieren kann, ist spannend. Sie verändert die Perspektive auf Blutflussregulation — weg vom rein lokalen Reagieren auf Aktivität hin zu einem vernetzten Prozess, der Schlaf und Reinigungsvorgänge unterstützt. Die Untersuchung von Resilienz und Verwundbarkeit dieser Neurone könnte neue präventive Strategien gegen Demenz eröffnen.« Solche Einschätzungen unterstreichen die Bedeutung integrierter Forschung, die Neurobiologie, Gefäßphysiologie und klinische Neurologie verknüpft.
Das Verständnis, wie Stress diese Neuronen beeinflusst, hat zudem relevante gesundheits‑ und präventivmedizinische Implikationen. Chronischer Stress ist in modernen Gesellschaften weit verbreitet; wenn er selektiv Zellen schwächt, die den zerebralen Blutfluss regulieren, könnten Stressreduktion, Schlafförderung und vaskulär protektive Maßnahmen praxisnahe Wege bieten, die Gehirngesundheit im Alter zu bewahren. Parallel dazu könnten Biomarker für Vasomotion, langsame Wellen oder nNOS‑assoziierte Signalwege helfen, frühe Funktionsverluste zu detektieren und gezielte Interventionen früher einzuleiten.
Quelle: sciencealert

Kommentar hinterlassen