5 Minuten
Ein mehrere Jahrzehnte altes Blutdruckmedikament, Hydralazin, hat eine überraschende molekulare Wirkung offenbart, die die Behandlung schwangerschaftsbedingter Hypertonie und sogar bestimmter Hirntumoren grundlegend verändern könnte. Forschende sehen in dieser Entdeckung die Chance für sicherere, gezieltere Therapien und eine beschleunigte Arzneimittelentwicklung durch das Repurposing eines etablierten Wirkstoffs.
Wie ein etabliertes Medikament einen verborgenen Mechanismus enthüllte
Wissenschaftlerinnen und Wissenschaftler, die untersuchten, warum Hydralazin bei Präeklampsie — einem gefährlichen Blutdruckanstieg in der Schwangerschaft — hilfreich ist, identifizierten einen bisher unbekannten molekularen Signalweg, auf den das Mittel einwirkt. Durch das systematische Kartieren der biochemischen Interaktionen von Hydralazin lässt sich nun erklären, wie klinische Effekte entstehen, und es eröffnet sich die Möglichkeit, Substanzvarianten zu entwickeln, die die Wirksamkeit erhalten, dabei aber Nebenwirkungen reduzieren. Diese Erkenntnisse betreffen sowohl vaskuläre als auch zelluläre Stresspfade und liefern Hinweise darauf, welche Zielmoleküle für eine selektivere Therapie in Frage kommen.
Die Chemikerin Megan Matthews von der University of Pennsylvania betont: Ein Verständnis von Hydralazin auf molekularer Ebene liefert eine Art Fahrplan für die Entwicklung sichererer und selektiverer Behandlungsoptionen bei schwangerschaftsbedingter Hypertonie. Das mechanistische Wissen hilft Forschenden und Pharmaunternehmen, gezielte Modifikationen vorzunehmen — etwa durch gezielte Substitutionsmuster, Prodrug-Strategien oder Formulierungsänderungen — um die pharmakologische Selektivität zu erhöhen. Ein praktischer Vorteil des Repurposings besteht darin, dass Hydralazin bereits zugelassen und klinisch gut charakterisiert ist; dadurch könnten optimierte Derivate oder neue Darreichungsformen in deutlich kürzerer Zeit als völlig neue Wirkstoffklassen Patienten zugänglich gemacht werden.
Warum das auch für Glioblastom und zielgerichtete Therapien relevant ist
Über die Geburtshilfe hinaus weisen die neuen Ergebnisse auf mögliche Schwachstellen von Glioblastomen hin — einer hochaggressiven Form des Hirnkarzinoms. Die Forschung legt nahe, dass Hydralazin in Signalwege eingreift, auf die glioblastomatische Zellen angewiesen sind, um zu überleben und sich progredient zu verhalten. Solche Pathways können Mechanismen der zellulären Stressantwort, der redox-balance, mitochondriale Funktionen oder Signaltransduktionskaskaden umfassen. Wenn es gelingt, das Molekül so zu modulieren, dass es selektiv die tumorischen Schutzmechanismen blockiert, ohne gesundes Gehirngewebe zu schädigen, könnte Hydralazin oder ein darauf basierendes Analogon eine wirksame Ergänzung zu bereits etablierten Krebsbehandlungen darstellen — etwa in Kombination mit Strahlentherapie, Chemotherapie oder zielgerichteten Inhibitoren.
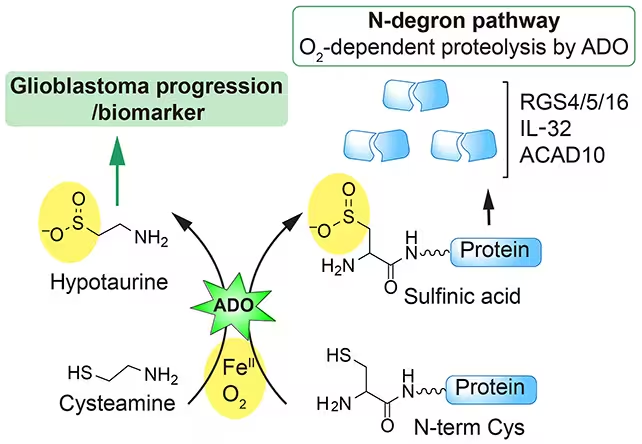
Balance zwischen Wirkungskraft und Sicherheit
Die Repurposing-Strategie bietet einen wichtigen Vorteil: bekannte Sicherheitsprofile. Für Hydralazin sind Nebenwirkungen wie Kopfschmerzen, Tachykardie oder ein medikamenteninduziertes Lupus-ähnliches Syndrom in der Literatur beschrieben, und diese Daten bilden eine solide Grundlage für Risiko-Nutzen-Abwägungen. Dennoch betonen Forschungsteams die Notwendigkeit, bei Anwendungen im Bereich Neuroonkologie oder Schwangerschaftskomplikationen besonders vorsichtig zu sein. Ziel ist es, therapeutische Fenster zu maximieren — also eine wirksame Hemmung tumor- oder pathophysiologisch relevanter Prozesse zu erzielen, während die Funktion gesunden Gewebes erhalten bleibt. Das erfordert gezielte medizinalchemische Optimierung: die Entwicklung von Hydralazin-Analoga mit erhöhter Affinität für tumor- oder placenta-spezifische Targetstrukturen, verbesserter Blut-Hirn-Schranken-Penetration für neuroonkologische Indikationen oder alternativen Formulierungen, die die systemische Belastung reduzieren.
Technisch bedeutet das, dass Pharmakologen und Medizinalchemiker gemeinsam an SAR-(struktur-wirkungs-)Analysen, ADME-Profilen (Absorption, Distribution, Metabolism, Excretion) und toxikologischen Studien arbeiten müssen. Präklinische Modelle, die sowohl humane Zelllinien als auch in vivo-Modelle (z. B. patientenabgeleitete Xenografts für Glioblastom) abbilden, sind entscheidend, um Selektivität und Wirksamkeit zu demonstrieren, bevor klinische Studien geplant werden. Parallel dazu sind Biomarker-Entwicklung und Diagnostik wichtig, um jene Patientengruppen zu identifizieren, die aufgrund molekularer Signaturen am ehesten von einer Hydralazin-basierten Therapie profitieren könnten.
Wie es für Patientinnen, Patienten und Forschende weitergeht
Das Forschungsteam veröffentlichte die Ergebnisse in Science Advances, einer peer-reviewed Fachzeitschrift, und skizzierte nächsten Entwicklungsschritte: Verfeinerung der Selektivität des Wirkstoffs, umfangreiche präklinische Tests in Glioblastom-Modellen sowie klinische Studien mit dem Ziel, die Behandlungsergebnisse für Frauen mit Präeklampsie zu verbessern. Konkrete Aktivitäten umfassen strukturelle Modifikationen des Hydralazin-Gerüsts, in vitro- und in vivo-Screenings zur Identifikation der wirksamsten Analogverbindungen, pharmakologische Studien zur Optimierung der Dosis-Wirkungs-Beziehung und Sicherheitsassessment in relevanten Tiermodellen. Diese Schritte sind essenziell, um die Übertragbarkeit von Laborbefunden in die klinische Praxis sicherzustellen.
Man stelle sich eine Zukunft vor, in der ein altes kardiovaskuläres Medikament, neu gestaltet auf Basis moderner molekularer Erkenntnisse, sowohl werdenden Müttern als auch Patientinnen und Patienten mit Hirntumoren hilft — ein effizienter Weg vom Forschungslabor an die klinische Versorgung. Es ist ungewöhnlich, dass ein klassisches Antihypertensivum neue Strategien für die Neuroonkologie aufzeigt, sagt Matthews, und viele im Feld hoffen, dass dies der Beginn weiterer interdisziplinärer Durchbrüche ist, die sich in konkrete, realweltliche Behandlungsoptionen übersetzen lassen. Parallel zu den experimentellen Arbeiten sollten Regulatorik-, Zulassungs- und Ethikfragen frühzeitig adressiert werden, um translationalen Stolpersteinen vorzubeugen und die Chancen für ein beschleunigtes, sicheres Repurposing zu nutzen.
Quelle: sciencealert

Kommentar hinterlassen