10 Minuten
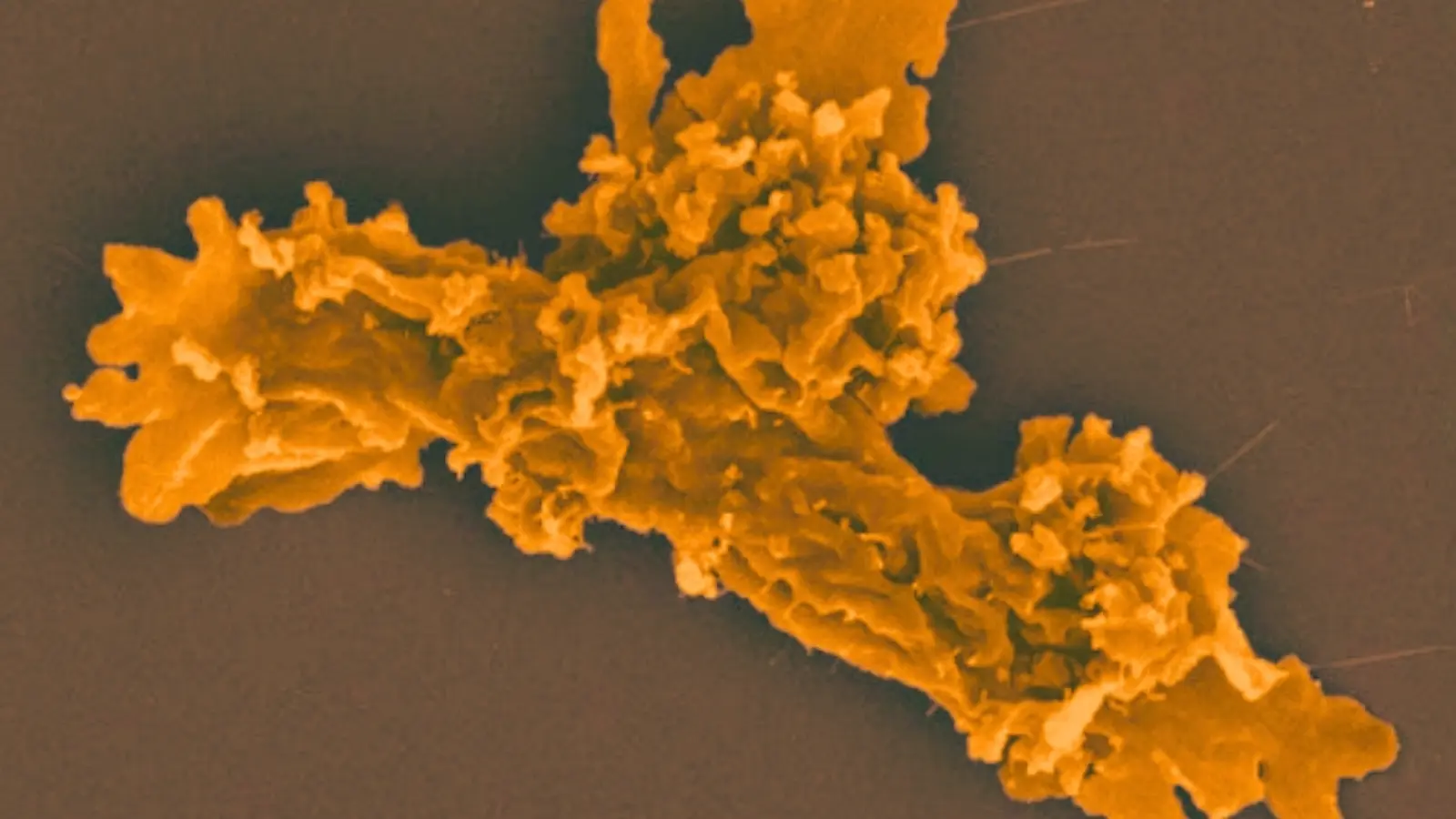
Ein einzelliges Lebewesen, entdeckt in den dampfenden Becken des Lassen Volcanic National Park, hat die wissenschaftlichen Vorstellungen darüber, was für komplexes Leben möglich ist, grundlegend verändert. Das neu beschriebene Incendiamoeba cascadensis gedeiht und teilt sich bei Temperaturen bis zu 63 Grad Celsius (145 °F) — ein Rekord für eukaryotische Organismen und eine dramatische Erweiterung der thermischen Grenzen für Leben mit Zellkern und Organellen.
A record-breaker: a eukaryote that prefers the heat
Die meisten Eukaryoten — die Domäne des Lebens, zu der Amöben, Pflanzen, Tiere und Pilze gehören — bevorzugen vergleichsweise milde Temperaturen. Menschen und viele Tiere funktionieren am besten in einem Bereich von etwa 20–37 °C, und jahrzehntelang gingen Forscher davon aus, dass eukaryotische Zellen bei Temperaturen oberhalb von etwa 60 °C versagen würden, weil ihre komplexen internen Membranen und Organellen unter Hitzestress besonders empfindlich sind.
Incendiamoeba cascadensis stellt diese Annahme auf den Kopf. Isoliert von einem Team unter der Leitung von H. Beryl Rappaport und Angela Oliverio an der Syracuse University und in einem bioRxiv-Preprint beschrieben, beginnt diese „Feueramöbe" erst oberhalb von 42 °C zu wachsen — sie ist damit ein obligater Thermophiler — und zeigt optimales Wachstum bei etwa 55–57 °C. Die Forscher beobachteten die Zellteilung (Mitose) direkt bei 58 °C und am Meilenstein von 63 °C, womit der frühere Amöbenrekord von 57 °C, aufgestellt durch Echinamoeba thermarum, übertroffen wurde.
Diese Beobachtungen sind nicht nur kulturelle Kuriositäten: sie belegen, dass eukaryotische Zellfunktionen — DNA-Replikation, Mitose, Membrantransport und Energiegewinnung in Mitochondrien — bei Temperaturen ablaufen können, die man bisher als für komplexe Zellen undenkbar hielt. Das hat direkte Relevanz für Forschungsthemen wie Thermostabilität von Proteinen, Evolution von Stressantworten und die ökologische Rolle thermophiler Eukaryoten in heißen Habitaten.
Field to flask: how researchers tested extreme limits
Rappaport, Oliverio und ihre Kollegen sammelten zwischen 2023 und 2025 Heißwasserproben quer durch den Lassen-Park und isolierten die Amöbe an 14 von 20 untersuchten Stellen. Im Labor kultivierten sie getrennte Proben in mehreren Flaschen und setzten Weizenkörner als Nährsubstrat ein, um bakterielles Wachstum anzuregen, von dem die bakterienfressende Amöbe lebt. Die Temperatur wurde zur zentralen experimentellen Variable: 17 Temperaturbedingungen von 30 bis 64 °C wurden getestet, mit vier Replikat-Flaschen pro Temperaturpunkt.
Bei solch systematischen Temperaturgradienten lässt sich die ökologische Nische einer Art präzise bestimmen. Die Forscher beobachteten, dass I. cascadensis unter 42 °C inaktiv blieb, zwischen etwa 55 und 57 °C am besten gedieh und sich sogar bei 64 °C noch bewegte. Bei 66 °C begann die Amöbe, schützende Zysten zu bilden — eine übliche Überdauerungsstrategie — und überraschenderweise wurde Zystenbildung auch schon bei 25 °C dokumentiert, eine ungewöhnlich hohe untere Grenze für Encystment.
Die Mobilität endete bei circa 70 °C, doch nach Abkühlung konnten Proben wieder reanimiert werden; ein irreversibler Zelltod wurde erst nahe 80 °C beobachtet. Solche Messungen erlauben eine feinere Einordnung in Begriffe wie Lebensfähigkeit (viability), Reproduktionsfähigkeit (fertility) und Dauerüberleben (persistence) unter extremen Temperaturen.
Methodisch ist hervorzuheben, dass das Team Kontrollen für mikrobiellen Wettbewerb, pH-Wert, Salzgehalt und Sauerstoffverfügbarkeit einsetzte, um die Effekte explizit auf Temperatur zurückzuführen. Zusätzlich kombinierten sie mikroskopische Zeitrafferaufnahmen mit Fluoreszenzmarkern für Membranintegrität und ATP-Level, wodurch sie unmittelbare physiologische Reaktionen auf Hitzestress dokumentieren konnten.
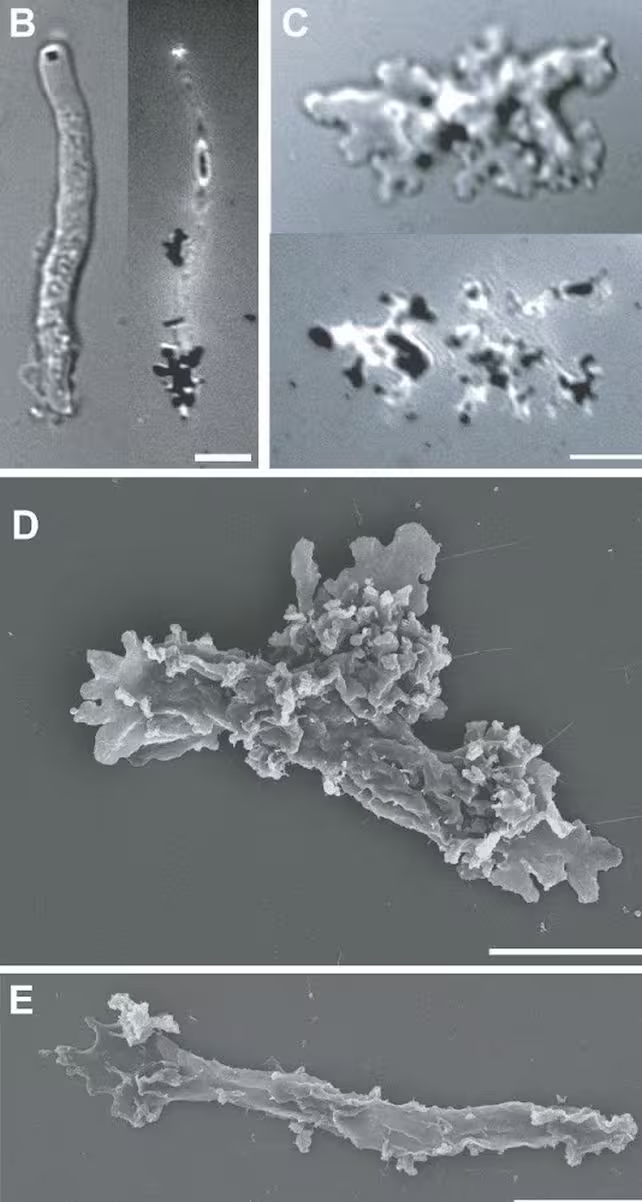
I. cascadensis in ihrem verlängerten wurmförmigen Zustand für schnellere Fortbewegung (B, E) und im amöboiden Zustand zum Fressen und Erkunden (C, D). (Rappaport et al., bioRxiv, 2025)
Genomics and survival strategies: what makes this amoeba heat-proof?
Genomanalysen lieferten wichtige Hinweise. Die DNA der Amöbe kodiert erweiterte Sets von Hitzeschockproteinen (heat-shock proteins, Hsp) und Chaperonen — molekulare Helfer, die andere Proteine unter Stress stabilisieren — sowie Anpassungen für schnelle zelluläre Signalgebung und hitzeantwortbezogene Signalwege. Diese molekularen Eigenschaften schützen vermutlich Membranen und essentielle Proteinkomplexe vor Denaturierung bei Temperaturen, die die meisten Eukaryoten lähmen würden.
Genauer zeigten die Sequenzdaten Vermehrungen bestimmter Hsp70- und Hsp90-Genkopien, Varianten von Proteinfaltungsfaktoren und Modifikationen in Lipidsynthesewegen, die die Membranzusammensetzung zugunsten hitzeresistenter Phospholipide verändern könnten. Darüber hinaus fand das Team Hinweise auf verringerte Anfälligkeit von DNA-Reparatur-Mechanismen gegenüber Hitze-induzierten Schäden, möglicherweise durch effizientere oder anders regulierte Reparaturproteine.
Im Vergleich zu den robustesten Prokaryoten — wie dem Archaeon Methanopyrus kandleri, das an Tiefsee-Schloten Temperaturen über 100 °C toleriert — tragen Eukaryoten empfindliche interne Membranen und Organellen wie Mitochondrien und Zellkern. Die Entdeckung eines Eukaryoten, der solche hohen Temperaturen nicht nur toleriert, sondern benötigt, zwingt zu einer Neubewertung evolutionärer Beschränkungen auf zelluläre Komplexität. Möglicherweise existieren evolutionäre Pfade, die spezielle molekulare Begleitsysteme (chaperone networks, heat-response pathways) selektieren, sodass Komplexität und Thermotoleranz koexistieren können.
Zusätzliche genomische Analysen suchten nach Hinweisen auf horizontalen Gentransfer (HGT) von thermophilen Prokaryoten. Einige Gene in I. cascadensis zeigten ungewöhnliche phylogenetische Verwandtschaften zu thermophilen Bakterien und Archaeen, was die Hypothese stützt, dass HGT in heißen Mikrohabitaten eine Rolle bei der Anpassung spielen könnte. Allerdings sind viele andere Anpassungen offensichtlich das Ergebnis von Genverdopplungen und adaptiver Evolution innerhalb der eukaryotischen Linie selbst.
Where else might the fire amoeba live?
Umwelt-DNA-Sequenzen (eDNA) nahezu identisch mit I. cascadensis tauchten in Proben aus dem Yellowstone-Nationalpark und der Taupō- Vulkanzone in Neuseeland auf. Umwelt-DNA repräsentiert keine vollständigen Organismen, aber diese Fragmente deuten darauf hin, dass die Amöbe — oder nahe Verwandte — in geothermischen Systemen weiter verbreitet sein könnten als die anfänglichen Lassen-Proben vermuten lassen.
Die geografische Verbreitung ist bedeutend: Existieren wärmeangepasste Eukaryoten in vielen hydrothermalen Habitaten der Erde, erweitert das die Arten von Umgebungen, die als potenziell bewohnbar für komplexe Zellen anderswo im Sonnensystem oder darüber hinaus betrachtet werden sollten. Solche Verbreitungsdaten unterstützen auch ökologische Modelle, die die Rolle thermophiler Eukaryoten in mikrobiellen Nahrungsnetzen und Nährstoffkreisläufen in heißen Habitaten berücksichtigen.
Gleichzeitig müssen Probenahme- und Nachweismethoden verbessert werden. eDNA ist empfindlich gegenüber Abbauprozessen, und direkte Isolierungen mit kulturbasierten Methoden, kombiniert mit Metagenomik und Einzelzell-Sequenzierung, sind entscheidend, um Verbreitung, Diversität und Ökologie solcher Organismen zuverlässig zu beschreiben.
Why this matters for ecology and astrobiology
Die Implikationen sind weitreichend. Praktisch könnten hitzetolerante eukaryotische Proteine und Chaperone die Entwicklung industrieller Enzyme inspirieren, die bei hohen Temperaturen funktionieren, was Prozesse in Biotechnologie, Lebensmittelproduktion oder Materialwissenschaften effizienter machen könnte. Ökologisch formen obligate Thermophile wie I. cascadensis mikrobiellen Nahrungsnetze in geothermischen Ökosystemen, indem sie Bakterien weiden und mit anderen Extremophilen interagieren, was Stoffflüsse und Energiebildung in diesen Nischen beeinflusst.
Für die Astrobiologie stellt der Fund konservative Annahmen darüber infrage, wo Leben möglich ist. Viele Modelle für außerirdische Bewohnbarkeit schließen hohe Temperaturen für komplexes Leben aus. Wenn eukaryotische Zellen bei Temperaturen über 60 °C operieren und sich teilen können, muss möglicherweise die Bandbreite potenzieller Lebensräume auf Himmelskörpern wie dem frühen Mars, eisigen Monden mit subsurface hydrothermaler Aktivität (z. B. Enceladus, Europa) oder Exoplaneten mit geothermischen Hotspots neu bewertet werden.
Das bedeutet nicht, dass hohe Temperaturen automatisch günstige Bedingungen für komplexes Leben sind, aber es erweitert das Spektrum an Umweltparametern, die Biologen und Planetologen in Habitabilitätsmodellen integrieren sollten. Zudem liefert die Studie konkrete molekulare Zielstrukturen (z. B. hitzestabile Chaperone), die in Sondexperimenten oder bei der Suche nach Biosignaturen in heißen Umgebungen von Interesse sein könnten.
Expert Insight
„Dieser Befund erweitert die Grenzen für eukaryotisches Leben“, sagt Dr. Lina Ortega, eine mikrobielle Ökologin, die nicht an der Studie beteiligt war. „Wir neigen dazu, Komplexität mit Zerbrechlichkeit gleichzusetzen, aber Incendiamoeba cascadensis zeigt, dass zelluläre Komplexität mit extremer Hitze kompatibel sein kann, wenn die Evolution unterstützende molekulare Systeme auswählt. Aus astrobiologischer Sicht bedeutet das, dass wir die Arten von planetaren Nischen, die wir modellieren und suchen, erweitern sollten.“
Weitere Expertinnen und Experten betonen, dass Replikationen und ergänzende Studien notwendig sind, um die Robustheit der Ergebnisse zu bestätigen: unabhängige Isolate, Langzeitkulturen, Proteomik unter verschiedenen Temperaturbedingungen und strukturelle Analysen hitzestabiler Proteine würden die Aussagekraft stark erhöhen.
Next steps and open questions
Wichtige Fragen bleiben offen. Wie hat I. cascadensis seine hitzestabile Maschinerie entwickelt — durch vertikale Vererbung, horizontalen Gentransfer oder eine Mischung beider Prozesse? Welche Grenzen hat seine metabolische Flexibilität, und kann die Art auch andere Extreme wie hohe Säurewerte, hoher Druck oder starke Oxidationsbedingungen tolerieren? Langfristige ökologische Untersuchungen, vergleichende Genomik und Laborversuche zur Proteinstabilität werden helfen, diese Fragen zu beantworten.
Zukünftige Forschungen könnten gezielte Experimente umfassen: Manipulation einzelner Hitzeschockgene mittels RNA-Interferenz oder CRISPR-Methoden (sofern anwendbar), Lipidom-Analysen zur Bestimmung membranbiologischer Anpassungen, sowie Ko-Kultur-Experimente, um trophische Interaktionen mit thermophilen Bakterien und Archaeen zu klären. Solche Studien würden nicht nur die Mechanismen der Thermotoleranz aufdecken, sondern auch die ökologische Rolle der Amöbe in geothermischen Gemeinschaften beleuchten.
Rappaport und Oliverios Team hat ihre Arbeit als Preprint auf bioRxiv veröffentlicht und lädt zur Peer-Review und zu Folgestudien ein. Ob diese Entdeckung eine isolierte evolutionäre Kuriosität darstellt oder den Beginn einer Reihe von bekannten „heißen" Eukaryoten markiert, sie erzwingt bereits ein wissenschaftliches Umdenken: Komplexes Leben kann an deutlich heißeren Orten bestehen, als bislang angenommen, und solche Orte verdienen eine erneute, gezielte Untersuchung in terrestrischen und außerirdischen Habitabilitätsstudien.
In praktischer Hinsicht sollten Forschungsförderer und Feldforscher künftig geothermische Habitate systematisch auf eukaryotische Diversität hin untersuchen, nicht nur auf prokaryotische Extremophile. Diese Ausweitung könnte neue Einblicke in die Evolutionsbiologie, Biotechnologie-Anwendungen und die Suche nach Leben jenseits der Erde liefern.
Quelle: sciencealert

Kommentar hinterlassen