5 Minuten
Neues Ziel für Knochenstärkung identifiziert
Ein multidisziplinäres Team der Universität Leipzig (Deutschland) und der Shandong University (China) hat einen zelloberflächenständigen Rezeptor, GPR133 (auch bekannt als ADGRD1), als wichtigen Regulator der Knochenbildung identifiziert. Die Entdeckung, berichtet in Signal Transduction and Targeted Therapy, zeigt, dass die Aktivierung dieses Rezeptors Osteoblasten — die Zellen, die Knochen aufbauen — stimuliert und in Mausmodellen die Knochenmasse und die mechanische Festigkeit erheblich erhöhen kann.
Genetische Varianten in GPR133 waren zuvor in menschlichen Genstudien mit Unterschieden in der Knochenmineraldichte assoziiert, was die Forschenden veranlasste, die biologische Rolle des Rezeptors näher zu untersuchen. Mithilfe einer Kombination aus Gen-Deletion-Modellen und einem kleinmolekularen Aktivator namens AP503 prüfte das Team, wie der Verlust oder die Stimulierung von GPR133 die Skelettentwicklung und den Knochenunterhalt beeinflusst.
Experimenteller Ansatz und zentrale Ergebnisse
Die Studie verwendete Mäuse, die entweder kein GPR133 exprimierten oder eine Version des Rezeptors trugen, die pharmakologisch stimulierbar war. Tiere ohne Rezeptor entwickelten eine verringerte Knochenmasse und strukturelle Anfälligkeit, die osteoporotischen Veränderungen ähnelte. Im Gegensatz dazu zeigten Mäuse, denen AP503 verabreicht wurde — ein durch computergestützte Suche identifizierter GPR133-Agonist — eine erhöhte Osteoblastenaktivität, stärkere Knochenbildung und messbare Verbesserungen der Knochenfestigkeit.
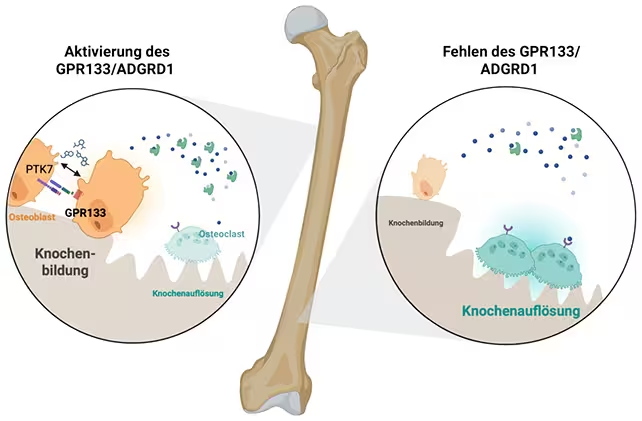
Mit aktiviertem GPR133 (links) sind die Osteoblasten (orange) dominanter. (Biorender, Ines Liebscher)
AP503 fungierte wie ein molekularer "Ein"-Schalter für Osteoblasten und steigerte die Knochenablagerung sowohl in gesunden Mäusen als auch in Modellen mit Knochenverlust. Die Forschenden prüften außerdem Kombinationen aus Rezeptoraktivierung und mechanischer Belastung (bewegungsähnliche Reize) und beobachteten additive Effekte: GPR133-Stimulierung plus körperliche Aktivität führten zu größeren Zuwächsen an Knochenmasse und Widerstandsfähigkeit als jede Intervention für sich.
Mechanismus in Kürze
GPR133 gehört zur Familie der Adhesion-G-Protein-gekoppelten Rezeptoren. Diese Rezeptoren leiten Signale über die Zellmembran hinweg, um intrazelluläre Signalwege zu aktivieren, die Zelldifferenzierung und -funktion steuern. In dieser Studie förderte die Aktivierung von GPR133 die Differenzierung und Aktivität von Osteoblasten und verschob das Gleichgewicht zugunsten der Knochenbildung gegenüber der Knochenresorption. Obwohl die detaillierte nachgeschaltete Signalkaskade noch weiter aufgeklärt werden muss, führt die Aktivierung zu einer erhöhten Rate der Ablagerung neuen Knochenmatrix und zu einer verbesserten Mikroarchitektur.
Auswirkungen auf Osteoporose und Alterung
Osteoporose ist eine chronische Erkrankung, die Knochen schwächt und das Frakturrisiko erhöht; sie betrifft weltweit Millionen und tritt besonders häufig nach den Wechseljahren auf. Aktuelle Therapien können weiteren Knochenabbau verlangsamen, stellen die bereits verlorene Knochenmasse jedoch meist nicht ohne Risiken oder nachlassende Wirksamkeit vollständig wieder her. Die Identifizierung von GPR133 als medikamentös ansprechbaren Rezeptor eröffnet einen möglichen Weg für anabole Behandlungen, die Knochen wieder aufbauen, anstatt nur die Resorption zu reduzieren.
Das Leipziger Team betont, dass die bisherigen Ergebnisse aus Tiermodellen stammen, doch die konservierte Natur der Osteoblastenbiologie deutet auf ein Übersetzungspotenzial hin. Wenn die GPR133-Funktion durch genetische Variation oder altersbedingten Abbau beeinträchtigt ist, könnten rezeptorgezielte Therapien entwickelt werden, um die Knochendichte bei Risikogruppen wie postmenopausalen Frauen und älteren Erwachsenen zu erhöhen.
„Durch pharmakologische Stimulierung von GPR133 beobachteten wir in den Modellen deutliche Zunahmen der Knochenfestigkeit“, sagte Ines Liebscher, eine in die Forschung involvierte Biochemikerin. Die Molekularbiologin Juliane Lehmann hob das Potenzial des Rezeptors für medizinische Anwendungen zur Bekämpfung von Skelettschwäche im Alter hervor.
Verwandte Technologien und nächste Schritte
Die Übersetzung dieser Entdeckung in klinische Behandlungen erfordert mehrere Schritte: Optimierung von GPR133-Agonisten hinsichtlich Potenz und Sicherheit, detaillierte Toxikologie und strenge präklinische Studien in größeren Tieren vor humanen Studien. Die Forschenden müssen zudem langfristige Effekte, Dosierungsstrategien und die Frage klären, ob eine Aktivierung etablierte Osteoporose sicher und ohne unerwünschte Nebeneffekte umkehren kann.
Fachlicher Kommentar Dr. Maria Andersen, Endokrinologin und unabhängige Forscherin für Knochenbiologie: „Diese Arbeit bietet eine vielversprechende anabole Strategie. Können GPR133-Agonisten verfeinert und beim Menschen als sicher nachgewiesen werden, könnten sie körperliche Aktivität und Ernährungsmaßnahmen ergänzen, um Knochen bei Patienten mit begrenzten Optionen wieder aufzubauen. Der weg-spezifische Ansatz verringert die Wahrscheinlichkeit breiter systemischer Effekte, aber eine sorgfältige klinische Prüfung ist unerlässlich.“
Fazit
Die Identifizierung von GPR133 als Regulator der osteoblastengesteuerten Knochenbildung eröffnet einen vielversprechenden neuen Weg für die Osteoporoseforschung. In Mäusen führte die Aktivierung des Rezeptors mit einem kleineren Molekül (AP503) zu mehr Knochenbildung und Festigkeit und wirkte synergistisch mit physischer Belastung. Obwohl die Übertragung in eine menschliche Therapie umfangreiche weitere Tests erfordert, könnte die gezielte Ansprache von GPR133 schließlich anabole Behandlungen hervorbringen, die abgebauten Knochen wiederherstellen und das Frakturrisiko in alternden Populationen reduzieren.
Quelle: sciencealert

Kommentar hinterlassen