8 Minuten
Entdeckung in Kürze: ein verborgener Rezeptor, der die Knochenstärke steuert
Forscher der Universität Leipzig identifizierten einen bislang wenig beachteten Rezeptor — GPR133 — der als molekularer "Knochen-Schalter" die Festigkeit des Skeletts kontrolliert. In Laborstudien an Mäusen erhöhte die Aktivierung von GPR133 durch ein neues kleines Molekül namens AP503 die Knochendichte und kehrte Veränderungen um, die der Osteoporose ähneln. Die Arbeit weist auf ein neues biologisches Ziel für Therapien hin, die sowohl Knochen erhalten als auch wiederaufbauen könnten — ein wichtiges Anliegen angesichts der alternden Bevölkerung.
Warum neue Osteoporose-Behandlungen dringend gebraucht werden
Osteoporose ist eine chronische Erkrankung, die durch fortschreitenden Verlust an Knochenmasse und mikroskopische Verschlechterung der Knochenstruktur gekennzeichnet ist und damit das Frakturrisiko erhöht. Allein in Deutschland sind ungefähr sechs Millionen Menschen betroffen, überwiegend Frauen, besonders nach der Menopause. Aktuelle Behandlungen — wie Bisphosphonate, Denosumab oder anabole Mittel wie Teriparatid und Romosozumab — können das Frakturrisiko senken, haben jedoch Einschränkungen, darunter Nebenwirkungen, begrenzte Anwendungsdauer und unvollständige Wiederherstellung der Knochenqualität. Es besteht ein dringender Bedarf an sichereren, langfristigen Strategien, die sowohl Knochenverlust verhindern als auch die Skelettintegrität wiederherstellen.
Um Alternativen mit besserem Sicherheits- und Wirksamkeitsprofil zu finden, erforschen Wissenschaftler neue molekulare Ziele in der Knochenbiologie. Ein vielversprechendes Ziel ist GPR133, ein Adhäsions-G-Protein-gekoppelter Rezeptor (Adhäsions-GPCR), der bis vor Kurzem kaum im Zusammenhang mit Knochenumbau untersucht wurde.
Mechanismus: Wie die Aktivierung von GPR133 Knochen umbaut
GPR133 gehört zu einer Klasse von Membranproteinen, den Adhäsions-GPCRs. Diese Moleküle werden durch mechanische Reize und Zell‑Zell-Kontakte aktiviert und leiten Signale über G‑Proteine ins Zellinnere weiter. Im Knochengewebe führt die Aktivierung von GPR133 zu einer Signalkaskade, die die Aktivität der Osteoblasten — der Zellen, die neuen Knochen bilden — erhöht und gleichzeitig die Aktivität der Osteoklasten — der Zellen für Knochenresorption — dämpft. Durch die Verschiebung des Gleichgewichts zugunsten der Knochenbildung stärkt die GPR133-Signalgebung die Knochenstruktur und verbessert die Belastbarkeit.
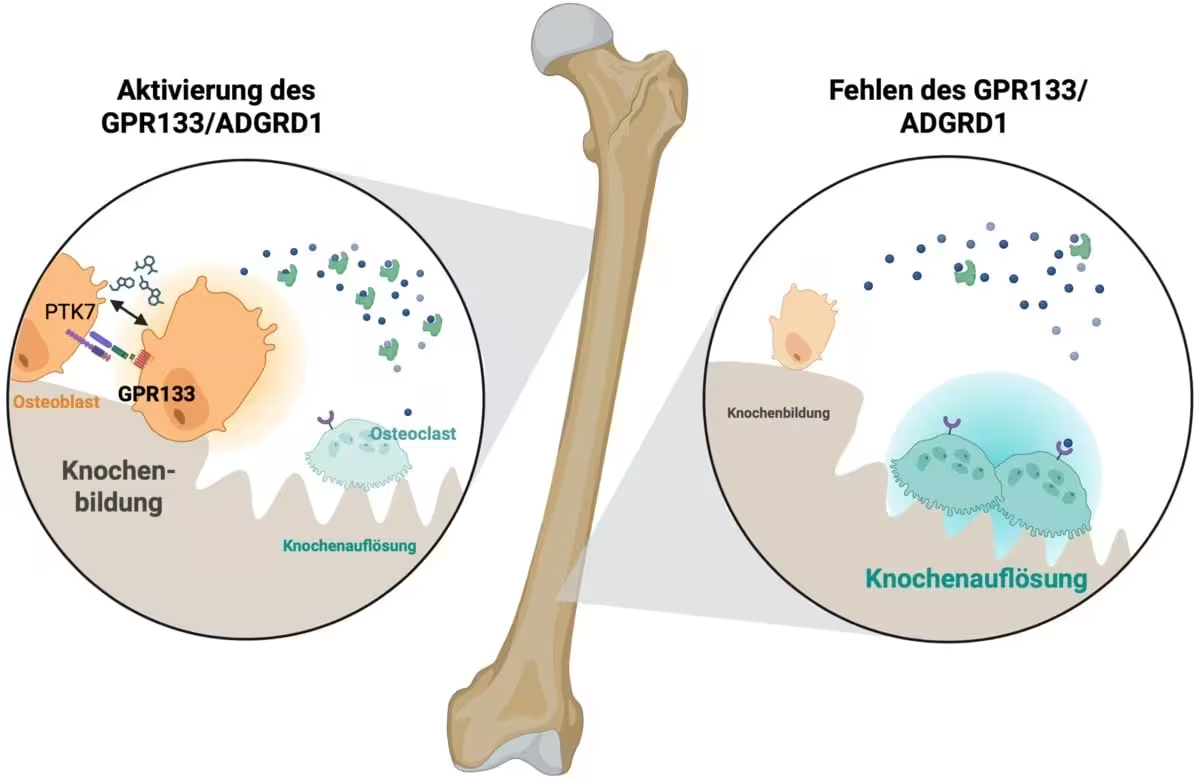
Wenn GPR133 im Knochengewebe aktiviert wird, löst es ein Signal aus, das knochenbildende Zellen (Osteoblasten) stimuliert und knochenabbauende Zellen (Osteoklasten) hemmt. Quelle: Biorender, Ines Liebscher
Laborversuche am Rudolf-Schönheimer-Institut für Biochemie zeigten, dass eine genetische Beeinträchtigung von GPR133 bei Mäusen zu frühzeitigen Reduktionen der Knochendichte führt, ein Phänotyp, der Aspekte der menschlichen Osteoporose widerspiegelt. Umgekehrt brachte die pharmakologische Stimulierung des Rezeptors mit AP503 — identifiziert durch computergestütztes Screening — beträchtliche Zunahmen an Knochenmasse und verbesserte mechanische Eigenschaften des Skeletts sowohl in gesunden als auch in osteoporotischen Tiermodellen.
Aktivierungsarten: mechanische Belastung und Zell‑Interaktionen
GPR133 spricht auf mechanische Belastung und auf Signale an, die aus direkten Interaktionen zwischen Knochenzellen entstehen. Diese doppelte Sensitivität legt nahe, dass der Rezeptor als physiologischer Integrator sowohl physikalischer Belastung (Bewegung, Belastung) als auch lokaler interzellulärer Signale fungiert und diese Hinweise in anabole (knochenaufbauende) Antworten übersetzt.
Studienergebnisse und experimentelle Details
In der Leipziger Studie kombinierten die Untersucher molekulargenetische Methoden, Zellbiologie und In-vivo-Pharmakologie. Zu den wichtigsten Befunden gehören:
- Mäuse mit eingeschränkter Funktion von GPR133 entwickelten bereits in jungen Altersjahren eine geringe Knochenmasse, was darauf hinweist, dass der Rezeptor für normalen Knochenaufbau und -erhalt erforderlich ist.
- AP503, ein durch Hochdurchsatz-Computerscreening entdeckter Wirkstoff, stimulierte selektiv GPR133 und reproduzierte dessen natürliche anabole Signalgebung im Knochen.
- Die Behandlung mit AP503 erhöhte die Knochenmineraldichte, verbesserte die Mikroarchitektur und kehrte osteoporoseähnliche Veränderungen bei behandelten Mäusen um.
Diese präklinischen Ergebnisse stützen die Idee, dass die gezielte Ansprache von GPR133 sowohl altersbedingtem Knochenverlust vorbeugen als auch bereits verlorenen Knochen aktiv wieder aufbauen könnte. Bemerkenswert ist, dass frühere Arbeiten derselben Gruppe zeigten, dass AP503 auch die Skelettmuskulatur stärkt, was auf koordinierte Vorteile für die muskuloskelettale Gesundheit hinweist — ein wünschenswertes Merkmal für Interventionen bei gebrechlichen, älteren Menschen.
Klinische Implikationen und Entwicklungsherausforderungen
Die Identifizierung von GPR133 und AP503 eröffnet einen translationalen Weg, bringt aber auch typische Herausforderungen mit sich:
- Sicherheit und Spezifität: Die Selektivität von AP503 für GPR133 und sein Off‑Target‑Profil müssen umfassend charakterisiert werden. Langfristige Modulation von GPCR‑Signalwegen erfordert sorgfältige Toxikologiestudien.
- Pharmakokinetik und Verabreichung: Chemische Optimierung kann nötig sein, um orale Bioverfügbarkeit, metabolische Stabilität und eine geeignete Dosierung für den Menschen sicherzustellen.
- Wirksamkeit in größeren Säugetieren und beim Menschen: Mausmodelle sind aufschlussreich, erfassen aber nicht vollständig die Dynamik des menschlichen Knochenumbaus. Studien an größeren Tieren und schließlich klinische Phasenversuche sind erforderlich, um Frakturrisikoreduktion und funktionelle Ergebnisse zu bewerten.
Da derzeitige Standardtherapien bereits das Frakturrisiko reduzieren, muss jede neue Therapie entweder eine überlegene Wirksamkeit, bessere Sicherheit für die Langzeitanwendung oder einzigartige Vorteile wie gleichzeitige Muskelstärkung nachweisen. Die Möglichkeit, sowohl Knochenverlust zu verhindern als auch Knochen zu regenerieren, macht GPR133 zu einem sehr attraktiven Ziel für die Arzneimittelentwicklung.
Hintergrund und Forschungskontext: ein Jahrzehnt GPCR‑Forschung in Leipzig
Die Universität Leipzig hat über ein Jahrzehnt in die strukturelle und funktionelle Untersuchung von Adhäsions‑GPCRs im Rahmen des Sonderforschungsbereichs 1423 "Structural Dynamics of GPCR Activation and Signaling" investiert. Diese langfristige, fokussierte Arbeit hat die Universität zu einem internationalen Zentrum für Adhäsions‑GPCR‑Forschung gemacht und multidisziplinäre Ansätze ermöglicht, die GPR133s Rolle in der Knochenbiologie offenbarten.
„Wenn dieser Rezeptor durch genetische Veränderungen beeinträchtigt ist, zeigen Mäuse bereits in jungen Jahren Anzeichen von Knochendichteverlust – ähnlich wie bei der Osteoporose des Menschen. Mit der Substanz AP503, die erst kürzlich über ein computerunterstütztes Screening als Stimulator von GPR133 identifiziert wurde, konnten wir die Knochenstärke sowohl bei gesunden als auch bei osteoporotischen Mäusen deutlich erhöhen“, erklärt Professorin Ines Liebscher, Studienleiterin am Rudolf‑Schönheimer‑Institut für Biochemie der Medizinischen Fakultät.
Fachliche Einschätzung
Dr. Martin Keller, fiktiver translationaler Pharmakologe und leitender F&E‑Berater mit Erfahrung in der muskuloskelettalen Arzneimittelentwicklung, kommentiert: "Die gezielte Ansprache von Adhäsions‑GPCRs wie GPR133 ist eine kluge Strategie, weil diese Rezeptoren an der Schnittstelle zwischen mechanischen Reizen und zellulärer Antwort liegen. Eine Verbindung, die sicher Übungssignale nachahmen und den Umbau zugunsten der Knochenbildung verschieben kann, könnte die Langzeitbehandlung der Osteoporose verändern — besonders für Patienten, die gegenwärtige Therapien nicht tolerieren. Der Weg von der Maus bis zur Zulassung ist lang, aber der kombinierte Muskel‑und‑Knochen‑Nutzen ist für die geriatrische Versorgung besonders vielversprechend."
Nächste Schritte und Zukunftsperspektiven
Das Leipziger Team verfolgt mehrere Anschlussprojekte, um den Wirkmechanismus von AP503 genauer zu definieren und die Rolle des Rezeptors in anderen Krankheitsmodellen zu testen. Wichtige nächste Schritte sind:
- Dosis‑Antwort‑ und Langzeitstudien zur Bewertung nachhaltiger Effekte und Sicherheit.
- Strukturelle Studien, um zu verstehen, wie AP503 an GPR133 bindet und den Rezeptor aktiviert, was eine rationale Optimierung der arzneimittelähnlichen Eigenschaften erleichtert.
- Studien in größeren Tiermodellen, um die menschliche Pharmakologie besser vorherzusagen.
- Frühe klinische Entwicklung, falls präklinische Sicherheit und Wirksamkeit bestätigt werden.
Wenn diese Wege erfolgreich voranschreiten, könnten GPR133‑Agonisten zur nächsten Generation von Osteoporose‑Therapien gehören, insbesondere für postmenopausale Frauen und ältere Menschen mit hohem Risiko für fragilitätsbedingte Frakturen.
Fazit
Die Entdeckung von GPR133 als Regulator der Knochenstärke und der Nachweis, dass ein kleines Molekül‑Aktivator, AP503, die Knochendichte steigern und osteoporoseähnliche Veränderungen bei Mäusen rückgängig machen kann, stellen einen vielversprechenden Fortschritt in der Knochenbiologie dar. Aufbauend auf einem Jahrzehnt Adhäsions‑GPCR‑Forschung an der Universität Leipzig liefert diese Arbeit sowohl ein neues therapeutisches Ziel als auch ein konzeptionelles Rahmenwerk für Interventionen, die mechanische und zelluläre Signale integrieren, um das Skelett zu erhalten und wiederaufzubauen. Obwohl die Überführung in eine humanmedizinische Behandlung umfangreiche Folgearbeiten erfordert, macht die kombinierte Fähigkeit, Knochen und Muskulatur zu stärken, die Modulation von GPR133 zu einem hochprioritären Ansatz zur Bekämpfung altersbedingter muskuloskelettaler Schwäche.
Wissenschaftler entdeckten einen „Knochen‑Schalter“, der Osteoporose stoppen und die Knochen mit dem Alter stark halten könnte. Quelle: Shutterstock
Wenn GPR133 im Knochengewebe aktiviert wird, löst es ein Signal aus, das knochenbildende Zellen (Osteoblasten) stimuliert und knochenabbauende Zellen (Osteoklasten) hemmt. Quelle: Biorender, Ines Liebscher
Quelle: scitechdaily

Kommentar hinterlassen