10 Minuten
Außergewöhnliche Lebenserwartung und was sie uns lehren kann
Es gibt kein Entkommen vor dem Altern, doch eine kleine Gruppe von Menschen — Supercentenarians, die 110 Jahre und älter werden — scheinen viele altersbedingte Erkrankungen hinauszuzögern. Eine umfassende molekulare und klinische Analyse von Maria Branyas, die 117 Jahre alt wurde, bietet ein seltenes Fenster in die biologischen Merkmale, die extreme menschliche Langlebigkeit unterstützen können. Der Fall vereint klinische Messungen, Multi‑Omic‑Profiling und genetische Untersuchungen, um Biomarker zu identifizieren, die mit gesundem Altern, robuster Immunfunktion und kardiovaskulärer Resilienz verbunden sind.

Maria Branyas in 1925
Die Studie, geleitet von Teams des Josep Carreras Leukämie‑Forschungsinstituts in Barcelona und veröffentlicht in Cell Reports Medicine, verwendete Blut-, Speichel-, Urin‑ und Stuhlproben, die vor Branyas' Tod im Jahr 2024 entnommen wurden. Die Forschenden — unter anderem die Epigenetiker Eloy Santos‑Pujol und Aleix Noguera‑Castells — berichten, dass sich einige von Branyas' Zellen und molekularen Signaturen so verhielten, als wären sie deutlich jünger als ihr kalendarisches Alter. Ihr Profil kombiniert günstige genetische Anlagen, einen niedrigen Entzündungszustand, ein ausgeprägtes Darmmikrobiom und kardiovaskuläre Marker, die mit einem geringeren Krankheitsrisiko einhergehen.
Studiendesign und Methoden: Proben, Analysen und Vergleichsrahmen
Zur Untersuchung der biologischen Grundlagen extremer Lebensdauer führten die Wissenschaftler eine multimodale Analyse durch: Ganzgenomsequenzierung, epigenetische Altersabschätzungen (Methylierungsuhren), detaillierte Lipidprofilierung, Immunzell‑Phänotypisierung und Darmmikrobiom‑Sequenzierung. Diese Datensätze wurden systematisch mit Referenzdaten jüngerer Kohorten und anderen älteren Personen verglichen, um Abweichungen zu identifizieren, die eher auf Resilienz als auf altersbedingten Abbau hindeuten.
Probenarten und Laboransätze
- Blut: genomische DNA, Immunzellzahlen, Entzündungsmarker und Lipidprofile.
- Speichel: zusätzliche DNA für Sequenzierung und Validierung keimbahngebundener Varianten.
- Urin: Stoffwechselnebenprodukte und Biomarker der Nierenfunktion.
- Stuhl: Zusammensetzung und Diversität des Mikrobioms mittels 16S rRNA und Shotgun‑Metagenomik.

Epigenetische Uhren schätzen das biologische Alter, indem sie DNA‑Methylierungsmuster über das Genom messen; zusätzlich wurden Telomere — die schützenden Kappen an Chromosomenenden — analysiert, um zelluläre Alterungsdynamiken zu bewerten. Qualitätskontrollen, Batch‑Effekt‑Korrekturen und Referenznormalisierungen waren wichtige Schritte, um vergleichbare Messwerte über Plattformen hinweg zu gewährleisten. Zusammen liefern diese molekularen Messungen eine geschichtete Perspektive auf die Altersbiologie: genetische Prädisposition, epigenetische Regulation, Immunfunktion und Mikrobiom‑Interaktionen.
In der Laborpraxis ist es wichtig, solche Multi‑Omic‑Daten durch robuste statistische Modelle zu integrieren. Methoden wie Adjustierung für Zellzusammensetzung, Korrektur für technische Artefakte und die Verwendung geeigneter Kontrollkohorten helfen, Signal von Rauschen zu trennen. Diese Sorgfalt ist entscheidend, wenn man Biomarker identifizieren möchte, die in unterschiedlichen Populationen stabil sind.
Zentrale Ergebnisse: ein junges molekulares Profil, günstige Lipide und geringe Entzündung
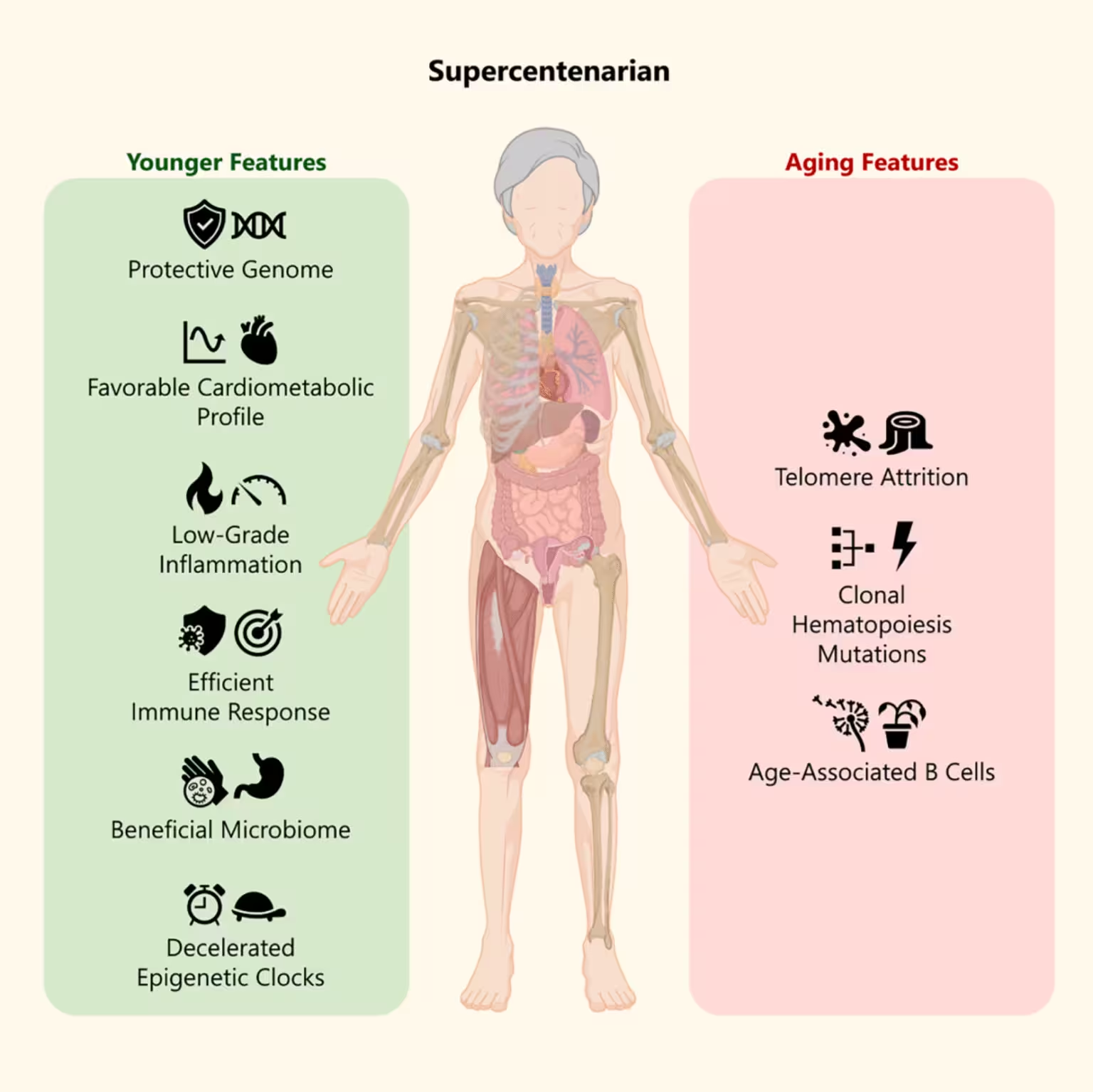
Mehrere konsistente Signale traten in der Analyse zutage. Trotz ihres hohen Alters zeigten viele von Branyas' zellulären und molekularen Markern Muster, die eher bei deutlich jüngeren Personen auftreten. Epigenetische Altersabschätzungen lagen in bestimmten Geweben unter ihrem kalendarischen Alter, was auf ein verlangsamtes epigenetisches Altern in ausgewählten Zelltypen hindeutet. Parallel dazu wies sie außergewöhnlich niedrige systemische Entzündungswerte auf — ein etablierter Prädiktor für bessere Gesundheit und geringere Morbidität im Alter.
Kardiometabolische Indikatoren waren ebenfalls auffällig: Branyas hatte sehr niedrige Werte für LDL‑Cholesterin und Triglyceride bei gleichzeitig ungewöhnlich hohen HDL‑Cholesterinwerten. Dieses Lipidprofil korreliert mit einem reduzierten Risiko für kardiovaskuläre Erkrankungen und könnte zu einer verlängerten Healthspan beigetragen haben. Die detaillierte Lipidfraktionierung deutete zudem auf eine effiziente Cholesterinverwertung und stabile Membranlipidzusammensetzung hin, was Zellfunktionen und Signalwege unterstützen kann.
Die Immunprofilierung zeigte ein robustes Bild adaptiver und angeborener Immunzellkomponenten. Subpopulationen von T‑Zellen und natürliche Killerzellen präsentierten Muster, die mit effektiver Immunüberwachung assoziiert werden, während entzündungsfördernde Zytokine wie IL‑6 und CRP auf niedrigen Niveaus lagen. Solche immunologischen Signaturen deuten auf eine Balance zwischen effektiver Abwehr und geringer chronischer Entzündung hin — ein Merkmal, das in vielen Studien mit besserer Gesundheit im hohen Alter verbunden ist.
Das Darmmikrobiom von Branyas ähnelte in wichtigen Metriken dem jüngerer Kohorten. Wichtige Befunde umfassten hohe mikrobielle Diversität und das gehäufte Vorkommen von Taxa, die kurzzeitige Fettsäuren (SCFAs) und andere antiinflammatorische Metaboliten produzieren, etwa Vertreter von Faecalibacterium oder Bifidobacterium. Solche Mikroben sind kopplungsfähig an Darmbarriere‑Funktionen und immunmodulatorische Effekte, was plausibel zur systemischen Homöostase beitragen kann.
Genetisch identifizierten die Forschenden mehrere seltene Varianten in Branyas' Genom, die mit Langlebigkeit, verbesserter Immunantwort und neuroprotektiven Mechanismen verknüpft sind. Diese Varianten betreffen oft Wege der DNA‑Reparatur, oxidativen Stressantwort und zellulären Homöostase — Mechanismen, die in vielen Langlebigkeitsstudien als zentral gelten.
Interessanterweise dokumentierte das Team eine „deutliche Erosion" der Telomere. Zwar werden kurze Telomere häufig mit erhöhter Mortalität assoziiert, doch jüngere Arbeiten zeigen, dass ihre prognostische Aussagekraft bei den Ältesten variieren kann. Die Autoren diskutieren die Hypothese, dass sehr kurze Telomere in bestimmten hochproliferativen Zelllinien die Chance für die Expansion maligner Klone begrenzen könnten — ein potenziell schützender Effekt gegen Krebs. Diese kontextspezifische Interpretation unterstreicht, dass Telomerlänge allein als Biomarker begrenzt aussagekräftig ist.
Jüngere Merkmale und altersbedingte Kennzeichen von Maria Branyas
In der Gesamtschau ergibt sich ein Bild gemischter Alterungssignale: molekulare Jugendlichkeit bei Immun‑ und epigenetischen Uhren, vorteilhafte Lipid‑ und Entzündungsprofile, ein Mikrobiom, das gesundheitsfördernde Metabolite liefert, und paradoxerweise sehr kurze Telomere. Diese Kombination plausibler Faktoren könnte erklären, wie Branyas die durchschnittliche Lebenserwartung von Frauen in Katalonien um mehr als drei Jahrzehnte übertraf. Darüber hinaus demonstriert der Fall, wie verschiedene biologische Ebenen — Genom, Epigenom, Metabolom und Mikrobiom — zusammenwirken können, um Robustheit gegenüber altersassoziierten Pathologien zu erzeugen.
Wissenschaftlicher Kontext und Implikationen für die Alternsforschung
Dieser Einzelfall trägt zu mehreren zentralen Themen der Langlebigkeitsforschung bei. Erstens ist extreme Langlebigkeit multifaktoriell: schützende genetische Varianten, günstiger Lebensstil (beispielsweise eine mediterrane Ernährung mit fermentierten Milchprodukten wie Joghurt), niedrige chronische Entzündung und eine resiliente Immunfunktion wirken gemeinsam. Zweitens zeigt der Fall, dass kein einzelner Biomarker das Altern vollständig beschreibt; Telomere, epigenetische Alterungsmaße und Mikrobiomzusammensetzung liefern jeweils Teilinformationen und können widersprüchliche Signale liefern.
Wissenschaftler warnen davor, aus einem Einzelfall zu verallgemeinern. Fallberichte sind exzellent zur Generierung von Hypothesen, ersetzen aber nicht groß angelegte, kontrollierte Studien. Zur Identifikation reproduzierbarer Biomarker und kausaler Mechanismen sind größere Kohorten von Hundertjährigen und Supercentenarians erforderlich. Längsschnittdaten, standardisierte Probenahmeprotokolle und multizentrische Studien sind unverzichtbar, um robuste, übertragbare Erkenntnisse zu gewinnen.
Die Forschenden betonen, dass ihre Ergebnisse „ein neues Licht auf die menschliche Altersbiologie werfen, Biomarker für gesundes Altern vorschlagen und mögliche Strategien zur Verlängerung der Lebenserwartung aufzeigen“ könnten. Künftige Arbeiten müssen die identifizierten genetischen Varianten und molekularen Signaturen in unabhängigen Kohorten validieren und experimentell testen, ob gezielte Modulationen des Mikrobioms, der Entzündungsreaktion oder epigenetischer Zustände tatsächlich gesunde Lebensjahre verlängern können — idealerweise in randomisierten, kontrollierten Interventionen.
Expertinneneinschätzung
Dr. Ana Cortes, eine fiktionale Geroscience‑Forscherin und Wissenschaftskommunikatorin, kommentierte die Relevanz der Studie: „Einzelfallstudien wie die von Maria Branyas sind außerordentlich wertvoll, weil sie uns herausfordern zu untersuchen, warum manche Menschen typische Alterungsmuster umgehen. Diese Arbeit verknüpft Genomik, Epigenetik und Mikrobiomforschung und weist auf integrierte Modelle der Resilienz hin. Zwar können wir nicht von einer Person auf die Allgemeinheit schließen, doch diese molekularen Signaturen liefern Ziele für größere Studien — insbesondere Signalwege, die Entzündungsprozesse und Immunüberwachung steuern.“
Ihre Einschätzung spiegelt den vorsichtigen Optimismus des Forschungsteams wider: Die Biologie extremer Langlebigkeit ist vielschichtig, doch messbare Merkmale — vom Lipidstoffwechsel über mikrobielle Metabolite bis zur epigenetischen Regulation — können Leitlinien für translationale Forschung bieten.
Praxisnahe Erkenntnisse und Ausblick
Für Klinik und Forschung hebt diese Analyse Kandidaten‑Biomarker hervor, die in Kohortenstudien langlebiger Menschen priorisiert werden sollten: epigenetische Uhren, Profile inflammatorischer Zytokine, detaillierte Lipidfraktionen und Metriken zur Mikrobiomdiversität. Solche Marker könnten in kombinierten Risikomodellen mit klinischen Parametern integriert werden, um prädiktive Algorithmen für gesunde Lebensspan(n)‑Prognosen zu entwickeln.
Für die breite Öffentlichkeit untermauern die Ergebnisse etablierte Empfehlungen für gesundes Altern: soziale und kognitive Teilhabe fördern, regelmäßige körperliche Aktivität pflegen, eine ausgewogene Ernährung — die mediterrane Kost wird wiederholt mit kardiovaskulärer Gesundheit in Verbindung gebracht — und chronische Entzündung sowie metabolische Risikofaktoren kontrollieren. Dabei ist zu betonen, dass individuelle Strategien von genetischen und sozialen Determinanten beeinflusst werden und personalisierte Ansätze sinnvoll sind.
Technologisch zeigt die Studie den Nutzen integrierter Multi‑Omics‑Ansätze — die Verbindung von Genomik, Epigenomik, Metabolomik und Mikrobiomik —, um ein systemisches Verständnis des Alterns zu entwickeln. Zukünftige Fortschritte in Einzelzellanalysen, longitudinaler Probenentnahme und interventionsbasierten Studien (beispielsweise gezielte Mikrobiommodifikation, personalisierte Ernährungsinterventionen oder Anti‑Inflamm‑Therapien) sind notwendig, um von Beobachtung zu praktikablen Therapien zu gelangen. Pilotstudien könnten etwa probiotische oder präbiotische Interventionen, präzise Anti‑Entzündungsstrategien oder epigenetisch modulierte Ansätze umfassen, die anhand vordefinierter Biomarker bewertet werden.
Darüber hinaus sind ethische und soziale Fragestellungen zu berücksichtigen: Zugang zu solchen Technologien, Datenschutz bei genetischen Daten und gesundheitliche Ungleichheiten müssen adressiert werden, damit therapeutische Erkenntnisse breit nutzbar und gerecht verteilt werden können.
Schlussfolgerung
Das molekulare Porträt von Maria Branyas zeigt, dass extremes Alter und erhaltene Gesundheit koexistieren können. Ihr Fall unterstreicht die Komplexität des Alterns: günstige genetische Varianten, ein in bestimmten Zelltypen jung wirkendes Epigenom, niedrige Entzündungswerte, ein resilientes Mikrobiom und vorteilhafte Lipidprofile ergeben zusammen ein Bild biologischer Widerstandskraft. Zwar kann ein Einzelfall keine kausalen Zusammenhänge beweisen oder auf alle Populationen übertragen werden, doch er bietet eine wertvolle Roadmap für künftige Untersuchungen, die darauf abzielen, Biomarker und Interventionen zu identifizieren, die gesundes Altern fördern und die gesunden Lebensjahre verlängern.
Die weltweit wachsende Zahl von Hundertjährigen macht diese Forschungsfragen zunehmend dringlich. Mit sorgfältiger Replikation, erweiterten Kohorten und interdisziplinären Ansätzen könnten die in außergewöhnlichen Individuen entdeckten molekularen Hinweise in Strategien münden, die mehr Menschen ein längeres, gesünderes Leben ermöglichen.
Quelle: sciencealert

.webp)
Kommentar hinterlassen