8 Minuten
Researchers reveal an alternative heat-producing system in brown fat
Forscher der Washington University School of Medicine in St. Louis haben einen bisher unentdeckten zellulären Weg identifiziert, über den braunes Fettgewebe (braunes Fett) Treibstoff verbrennt und Wärme erzeugt. Die Entdeckung, die in Nature veröffentlicht wurde, beschreibt einen peroxisomzentrierten Mechanismus, der als eine Art "Backup-Heizung" fungieren kann, wenn die klassische mitochondriale Thermogenese geschwächt ist. Dieser Pfad hängt von dem Enzym Acyl-CoA-Oxidase 2 (ACOX2) ab und scheint den gesamten Stoffwechsel, die Insulinsensitivität sowie die Gewichtskontrolle bei Mäusen zu beeinflussen.
Braunes Fett unterscheidet sich von weißem Fettgewebe (weißes Fett) und Skelettmuskulatur dadurch, dass seine Hauptfunktion die adaptive Thermogenese ist — also die Umwandlung von Kalorien in Wärme zur Aufrechterhaltung der Körpertemperatur bei Kälte. Jahrzehntelang galt das mitochondriale Entkopplungsprotein 1 (UCP1) als der zentrale molekulare Schalter, der die mitochondriale Energieumwandlung in Wärme umlenkt. Frühere Beobachtungen hatten jedoch gezeigt, dass Tiere ohne UCP1 einen Teil ihrer Fähigkeit zur Wärmeerzeugung behalten können, was auf alternative thermogenetische Mechanismen hindeutet.
Peroxisomes and ACOX2: a complementary thermogenic route
Die neue Studie rückt Peroxisomen — kleine Organellen, die auf Fettsäurestoffwechsel spezialisiert sind — in den Mittelpunkt dieses alternativen thermogenetischen Systems. Die Forschenden beobachteten, dass Kälteeinwirkung die Proliferation von Peroxisomen im braunen Fett stimuliert. Diese Reaktion war bei Mäusen, denen genetisch UCP1 fehlt, noch ausgeprägter, was darauf hindeutet, dass Peroxisomen kompensatorisch aktiv werden können, wenn die mitochondriale Entkopplung eingeschränkt ist.
Lodhi und seine Kollegen konnten die kompensatorische Aktivität auf ein Enzym in Peroxisomen zurückführen: Acyl-CoA-Oxidase 2 (ACOX2). In Mausmodellen, in denen ACOX2 spezifisch im braunen Fett entfernt wurde, hatten die Tiere Schwierigkeiten, bei Kälteeinwirkung normale Körpertemperaturen aufrechtzuerhalten, und zeigten eine verschlechterte Insulinantwort. Unter einer kalorienreichen, fettreichen Diät nahmen diese Mäuse mehr Gewicht zu als ihre Kontrollkollegen.
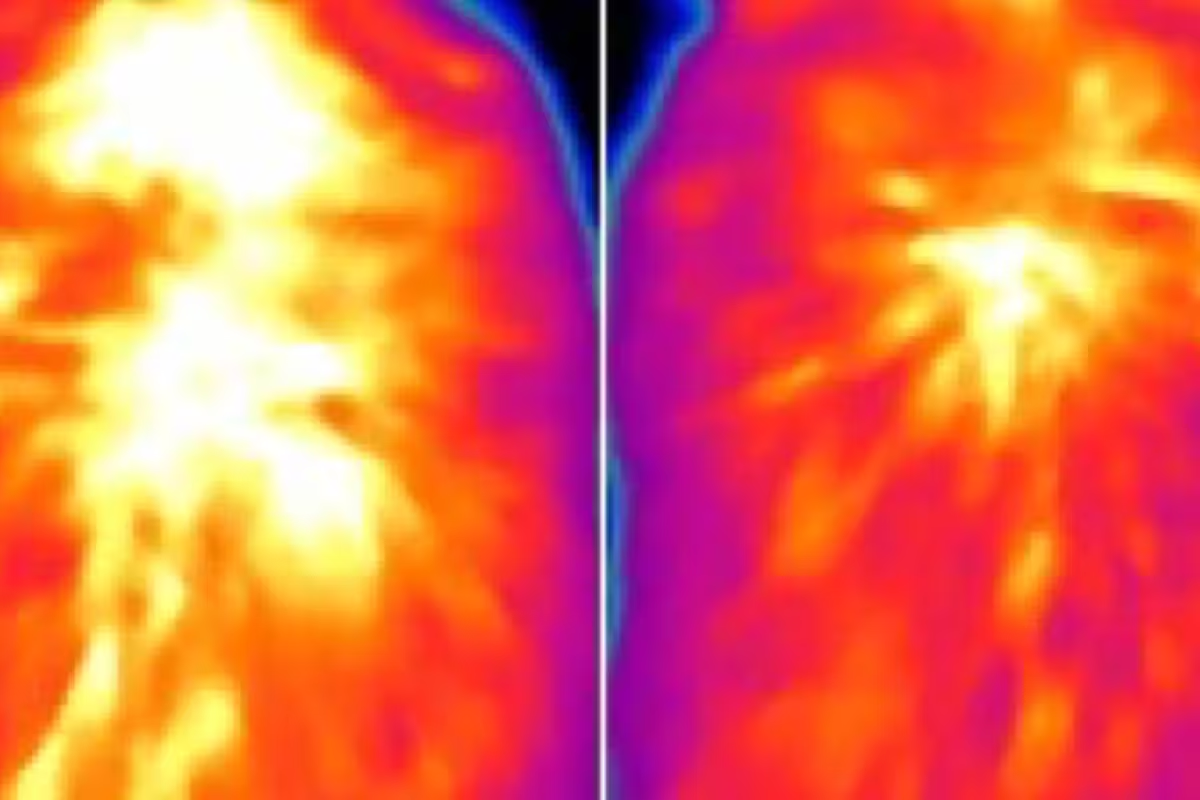
Die von WashU Medicine geleitete Studie eröffnet mögliche neue Ansätze, braunes Fett gezielt zu nutzen, um metabolische Erkrankungen wie Adipositas zu behandeln. Infrarotaufnahmen zeigen reduzierte Wärmeabgabe des braunen Fetts in einer Maus ohne das Protein ACOX2 (rechts) im Vergleich zu einer Kontrollmaus. Die Wiederherstellung hoher ACOX2-Spiegel im braunen Fett erhöhte die Wärmeproduktion und verbesserte die Gewichtskontrolle, selbst bei Mäusen auf einer fettreichen Diät.
Umgekehrt zeigten Mäuse, die darauf programmiert waren, ACOX2 selektiv im braunen Fett zu überexprimieren, eine gesteigerte Thermogenese, größere Kältetoleranz und verbesserte metabolische Marker. Dazu zählten eine höhere Insulinsensitivität und Schutz vor einer diätinduzierten Adipositas. Mit einem für die Studie entwickelten fluoreszenten Hitzesensor beobachteten die Forschenden direkt, dass ACOX2‑abhängiger Stoffwechsel bestimmter Fettsäuren die intrazelluläre Temperatur in braunen Adipozyten erhöhte. Ergänzende Infrarot-Thermografie bestätigte die reduzierte Wärmeabgabe des braunen Fetts in ACOX2-defizienten Tieren.
Scientific background: how peroxisomal thermogenesis differs from mitochondrial pathways
Die mitochondriale Thermogenese über UCP1 funktioniert, indem Protonen die innere mitochondriale Membran passieren, ohne ATP-Synthese anzutreiben, wodurch die gespeicherte elektrochemische Energie als Wärme freigesetzt wird. Peroxisomale Thermogenese ist mechanistisch anders: Peroxisomen oxidieren spezifische Fettsäuren in Reaktionen, die Wärme und Metaboliten erzeugen, ohne direkt an den mitochondrialen Protonengradienten gekoppelt zu sein. ACOX2 katalysiert dabei den ersten Schritt der peroxisomalen Beta-Oxidation bestimmter verzweigter und langkettiger Fettsäuren.
Dieser alternative Weg "verschwendet" chemische Energie bewusst als Wärme und erhöht dadurch den Ruheenergieverbrauch. Aus therapeutischer Perspektive könnte die Steigerung der peroxisomalen Aktivität im braunen Fett den täglichen Kalorienverbrauch erhöhen, ohne dass dafür zusätzliche körperliche Aktivität notwendig wäre — eine potenzielle Ergänzung zu Ernährungs- und Bewegungsinterventionen. Solche Ansätze müssten jedoch unterscheiden, wie viel gezielte Anregung nötig ist, um klinisch relevante Effekte zu erzielen, ohne metabolische Nebenwirkungen zu verursachen.
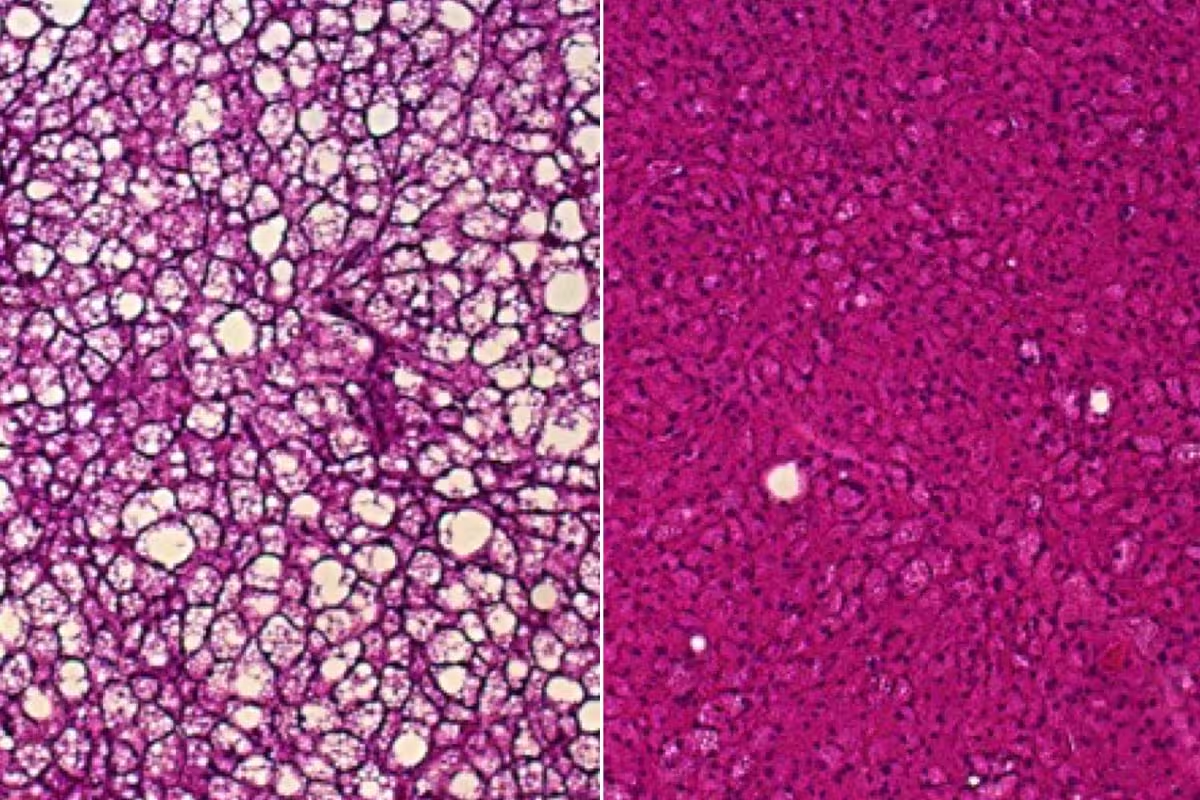
Die Studie zeigt zudem histologische Befunde, die den funktionellen Effekt untermauern. Braunes Fettgewebe von Mäusen, denen das Entkopplungsprotein UCP1 fehlt und die mit einer fettreichen Diät gefüttert wurden, weist eine Anhäufung weißer Fetttropfen auf (links), was ein Zeichen für gestörte Wärmeproduktion ist. Im braunen Fett von Mäusen, die ebenfalls kein UCP1 haben, aber genetisch so verändert wurden, dass sie ungewöhnlich hohe Mengen an ACOX2 produzieren, sammelt sich bei fettreicher Ernährung kein weißes Fett an (rechts) und die Wärmeproduktion bleibt höher.
Implications for human health and potential interventions
Obwohl die aktuellen Experimente an Mäusen durchgeführt wurden, deuten mehrere Hinweise darauf hin, dass dieser Mechanismus für den Menschen relevant sein könnte. Bestimmte Fettsäuren, die von ACOX2 metabolisiert werden, kommen natürlich in der menschlichen Muttermilch und in Milchprodukten vor und werden zudem von einigen Darmmikroben produziert. Beobachtungsstudien haben zuvor höhere zirkulierende Werte dieser Fettsäuren mit einem geringeren Body‑Mass‑Index bei Menschen verknüpft, wobei eine Kausalität jedoch noch nicht nachgewiesen ist.
Die Autor:innen der Studie schlagen mehrere translationale Ansätze vor: ernährungsbasierte Strategien zur Erhöhung der Aufnahme oder der endogenen Produktion der relevanten Fettsäuren (über Präbiotika, Probiotika oder gezielte Lebensmittelbestandteile), nutraceutical‑Formulierungen oder kleine Molekülwirkstoffe, die ACOX2 direkt aktivieren oder die Peroxisomenbiogenese in braunen Adipozyten fördern. Jede dieser Strategien würde eine gründliche präklinische Prüfung von Sicherheit und Wirksamkeit erfordern, bevor klinische Studien am Menschen begonnen werden könnten.
Der leitende Autor Irfan Lodhi, PhD, betonte die therapeutische Zielsetzung: Eine Erhöhung der peroxisomgetriebenen Thermogenese könnte den Ruheenergieverbrauch steigern und so helfen, Gewichtsverluste zu stabilisieren. Er bemerkte, dass dieser Ansatz für manche Menschen leichter aufrechtzuerhalten sein könnte als langfristige Kalorienrestriktion oder intensives Training, weil er die basalen Stoffwechselprozesse ergänzt, anstatt ausschließlich auf Verhaltensänderungen zu setzen.
Experimental tools and technologies used
Wichtige Techniken in der Studie umfassten:
- Genetische Mausmodelle mit gewebespezifischer Deletion oder Überexpression von ACOX2 und UCP1, um ursächliche Zusammenhänge zu testen.
- Kälteexpositionsprotokolle, um thermogenetische Reaktionen gezielt auszulösen und physiologische Anpassungen zu messen.
- Ein fluoreszenter intrazellulärer Hitzesensor, speziell entwickelt, um kleine, lokal begrenzte Temperaturänderungen innerhalb brauner Adipozyten nachzuweisen und damit direkte Hinweise auf zelluläre Wärmeproduktion zu liefern.
- Infrarot-Thermografie zur kartografischen Erfassung der Wärmeabgabe aus braunen Fettdepots in lebenden Tieren und zur Validierung zellulärer Messungen im Organismenkontext.
- Metabolische Phänotypisierung, einschließlich Glukose- und Insulintoleranztests sowie Körperzusammensetzungsanalysen unter Bedingungen einer fettreichen Diät, um systemische Effekte zu erfassen.
Diese Methoden ermöglichten es dem Team, molekulare Veränderungen der peroxisomalen Funktion mit messbaren Effekten auf den Energiehaushalt und den Glukosestoffwechsel des gesamten Organismus zu verknüpfen. Die Kombination aus molekularen, zellulären und in vivo‑Techniken stärkt die Aussagekraft der Befunde und liefert multimodale Evidenz für die Rolle von ACOX2.
Expert Insight
"Diese Forschung fügt unserer Vorstellung von der Plastizität des Fettgewebes eine wichtige Ebene hinzu", sagt Dr. Elena Morales, eine auf Stoffwechselphysiologie spezialisierte Wissenschaftlerin, die nicht an der Studie beteiligt war. "Peroxisomen werden in Diskussionen über Energiegleichgewicht oft übersehen, dabei können sie die zelluläre Treibstoffnutzung grundlegend verändern. Wenn es gelingt, die peroxisomale Aktivität im menschlichen braunen Fett sicher zu modulieren, könnte das einen neuen Weg eröffnen, die metabolische Gesundheit zu unterstützen — möglicherweise ohne die systemischen Nebenwirkungen, die einige frühere pharmakologische Ansätze eingeschränkt haben."
Future directions and challenges
Die Überführung dieser Entdeckung in menschliche Anwendungen wirft mehrere Fragen auf: Exprimieren menschliche Depots von braunem Fett ACOX2 in funktionell relevanten Mengen? Welche spezifischen diätären Fettsäuren oder mikrobiellen Metaboliten aktivieren diesen Pfad am effektivsten? Lassen sich peroxisomzielende Therapien so gestalten, dass sie gewebespezifisch wirken und unerwünschte Effekte in Leber oder anderen Organen vermeiden, in denen peroxisomaler Stoffwechsel essentiell ist?
Um diese Fragen zu beantworten, sind vergleichende Studien an menschlichem Gewebe, sorgfältig kontrollierte Ernährungsinterventionen und zielgerichtete Wirkstoffentwicklung notwendig, um sichere Aktivatoren von ACOX2 oder Induktoren der Peroxisomenbiogenese zu identifizieren. Langfristige Sicherheitsaspekte werden besonders wichtig sein, denn die Veränderung des basalen Energieverbrauchs kann komplexe endokrine und metabolische Folgen nach sich ziehen, die über einfache Gewichtsveränderungen hinausgehen.
Conclusion
Die Entdeckung der ACOX2‑abhängigen peroxisomalen Thermogenese im braunen Fett offenbart einen neuartigen Mechanismus, über den Organismen Energie aufwenden und die metabolische Gesundheit beeinflussen können. Bei Mäusen führte die Aktivierung dieses Pfades zu einer besseren Kältetoleranz, erhöhter Insulinsensitivität und Resistenz gegenüber diätinduzierter Adipositas; der Verlust des Pfades hatte gegenteilige Effekte. Obwohl umfangreiche Arbeit nötig ist, um das translationale Potenzial beim Menschen zu prüfen, erweitert diese Forschung das Repertoire potenzieller Interventionen gegen Adipositas und Stoffwechselkrankheiten. Als vielversprechende Ansätze zeichnen sich diätetisch abgeleitete Fettsäuren, die Modulation des Darmmikrobioms sowie direkte pharmakologische Aktivatoren der peroxisomalen Signalwege ab.
Quelle: scitechdaily


Kommentar hinterlassen