10 Minuten
Pränatale Umgebung und lebenslanges Angstrisiko
Jüngste experimentelle Arbeiten an Mäusen deuten darauf hin, dass eine erhöhte Anfälligkeit für Angststörungen im Erwachsenenalter bereits vor der Geburt entstehen kann. Forscher an der Weill Cornell Medicine berichten, dass mütterliche Infektionen oder chronischer Stress in der Schwangerschaft dauerhafte molekulare und schaltungsbezogene Spuren im Gehirn des Nachwuchses hinterlassen können, die später zu verstärktem ängstlichem Verhalten führen. Die Studie identifiziert spezifische Veränderungen im ventralen Dentatgyrus (vDG), einer Unterregion des Hippocampus, die an Bedrohungsbewertung und Vermeidungsverhalten beteiligt ist, und verbindet diese Veränderungen mit einer epigenetischen Reprogrammierung der Genregulation in Neuronen.
Diese Ergebnisse veranschaulichen, wie pränatale Einflüsse nicht nur kurzfristige Entwicklungsstörungen verursachen, sondern auch langfristig die Funktionsweise bestimmter neuronaler Netzwerke prägen können. Solche Erkenntnisse sind relevant für das Verständnis von Entstehungsmechanismen psychischer Erkrankungen und eröffnen mögliche Ansätze für Frühdiagnose und gezielte Interventionen.
Studienaufbau: Modellierung mütterlicher Entzündung
Um zu untersuchen, wie pränatale Belastungen die Gehirnentwicklung beeinflussen, verwendete das Team genetisch veränderte Mausstämme, die eine erhöhte inflammatorische Signalgebung in der trächtigen Mutter simulieren. Dieser Ansatz reproduziert Aspekte mütterlicher Infektion oder anhaltenden physiologischen Stresses, ohne dass veränderte Stressantwort-Gene direkt an die Nachkommen vererbt werden. Die Forschenden beobachteten die Nachkommen bis ins Erwachsenenalter und analysierten Verhalten, neuronale Aktivität und DNA-Modifikationen in gezielten Hirnregionen.
Methodisch kombiniert die Arbeit Verhaltensassays mit molekularen Profilen und bildgebenden bzw. elektrophysiologischen Messungen, um eine Verbindung zwischen veränderten epigenetischen Signaturen und funktioneller Schaltungsdynamik herzustellen. Solche integrierten Ansätze stärken die Aussagekraft, weil sie mehrere Ebenen biologischer Organisation verbinden: vom Molekül über die Zelle bis zur Schaltung und zum Verhalten.
Die Autoren erläutern, dass das Modell typische Komponenten mütterlicher Entzündungsreaktionen nachbildet — zum Beispiel veränderte Zytokinprofile —, ohne jedoch zu behaupten, dass exakt dieselben Mechanismen eins zu eins auf Menschen übertragbar sind. Vielmehr dient das Modell dazu, plausible biologische Pfade und kausale Zusammenhänge zu identifizieren, die in nachfolgenden Studien weiter geprüft werden müssen.
Fokus auf männliche Nachkommen für Verhaltensuntersuchungen
Die Forschenden konzentrierten sich bei den Verhaltenstests überwiegend auf männliche Nachkommen, weil diese in ihrem Modell stärkere angstähnliche Verhaltensweisen zeigten. Obwohl diese männlichen Tiere genetisch normal waren (sie erbten nicht die genetisch veränderte Entzündungsprädisposition), zeigten sie im Erwachsenenalter konsistente Zeichen erhöhter Ängstlichkeit — etwa eine deutlich stärkere Präferenz für geschützte Bereiche und eine ausgeprägte Vermeidung offener Flächen — im Vergleich zu Kontrolltieren.
Die geschlechtsspezifischen Unterschiede sind bemerkenswert und weisen darauf hin, dass biologische Variablen wie hormonelle Milieus, Geschlechtschromosomen oder entwicklungsbedingte Zeitfenster die Vulnerabilität gegenüber pränatalen Stressfaktoren modulieren können. Künftige Studien sollten deshalb auch weibliche Tiere systematisch einschließen und geschlechtsspezifische Mechanismen untersuchen, um ein vollständigeres Bild der Risikofaktoren zu erhalten.
Neuronale Schaltkreise: Überaktive Neurone im ventralen Dentatgyrus
Bei bedrohlichen Reizen zeigten die betroffenen Mäuse eine übermäßige Aktivierung einer Untergruppe von Neuronen im ventralen Dentatgyrus (vDG). Der vDG trägt zur Einschätzung potenzieller Gefahren in der Umgebung und zur Steuerung von Verhaltensreaktionen bei; eine Überaktivierung dieser Region kann Gefahrsignale verstärken und das Tier zu vermehrtem Vermeidungsverhalten neigen lassen. Die Autorinnen und Autoren beschreiben, dass pränatale Belastungen bleibende Eindrücke auf vDG-Neurone hinterlassen haben, die die Reaktionsweise dieser Zellen auf unsichere Kontexte im erwachsenen Tier veränderten.
Auf der Ebene der Schaltung lässt sich daraus ableiten, dass eine relativ kleine, aber funktional relevante Unterpopulation von Neuronen die Balance zwischen Erkundung und Vermeidung verschiebt. Solche Verschiebungen können sich in veränderten Synapseneigenschaften, geänderten Inhibitions-Exzitations-Verhältnissen oder veränderten Netzwerkoszillationen niederschlagen, die zusammen das Verhaltensprofil formen.
"Unsere Daten zeigen, dass pränatale Belastungen bleibende Spuren in den Neuronen des vDG hinterlassen und so den Zusammenhang zwischen dem gestationellen Umfeld und angstähnlichem Verhalten herstellen", sagte Neuropharmakologe Miklos Toth, Co-Autor der Studie. "Dieser Mechanismus könnte erklären, warum einige Individuen eine anhaltende Stresssensitivität und verstärkte Vermeidungstendenzen zeigen."
Epigenetische Reprogrammierung: DNA-Methylierung und Genexpression
Zur Untersuchung molekularer Mechanismen bestimmten die Forschenden DNA-Methylierungsmuster in neuronalen Geweben des vDG. DNA-Methylierung ist eine epigenetische Markierung, die Genaktivität dämpfen oder modulieren kann, ohne die zugrunde liegende DNA-Sequenz zu verändern. Sie fanden Tausende unterschiedlich methylierten Stellen im vDG von pränatal belasteten Mäusen, wobei diese Veränderungen insbesondere in Genregionen gehäuft auftraten, die synaptische Kommunikation und neuronale Erregbarkeit regulieren.
Solche epigenetischen Modifikationen betreffen häufig regulatorische Elemente wie Promotoren oder Enhancer und können die Transkriptionsdynamik von Schaltkreisen beeinflussen. In der Studie korrespondierten die methylierungsveränderten Regionen mit Genen, die an der Signalübertragung, Ionenkanalregulation und synaptischen Plastizität beteiligt sind — Prozesse, die direkt die Fähigkeit von Neuronen bestimmen, auf Eingaben zu reagieren und Netzwerke zu synchronisieren.
Diese epigenetischen Veränderungen waren auf einen kleinen Bruchteil der vDG-Neurone konzentriert. "Ein MausvDG enthält nahezu 400.000 Zellen, aber nur wenige tausend sind während der Schwangerschaft betroffen", bemerkte Toth. Sobald die Tiere einem bedrohlichen Kontext ausgesetzt wurden, zeigten diese umprogrammierten Neurone eine verstärkte Aktivität — konsistent mit einer Schaltung, die dazu neigt, Gefahr zu überschätzen und Vermeidung zu begünstigen.
Die molekularbiologische Co-Autorin Kristen Pleil fasste die funktionale Konsequenz zusammen: "Insgesamt weisen diese epigenetischen Veränderungen bestimmte Neurone im vDG an, im Erwachsenenalter anders auf unsichere Umgebungen zu reagieren. Die Zellen zeigen übermäßige Aktivität, was dazu beiträgt, dass die Mäuse ihre Umgebung als bedrohlicher wahrnehmen, als sie tatsächlich ist."
Technisch betrachtet eröffnet die Identifikation solcher epigenetischer Muster die Möglichkeit, mit Einzelzellmethoden wie scBS-seq oder single-nucleus methylation sequencing präziser zu kartieren, welche Zelltypen betroffen sind — z. B. excitatorische Granule cells versus verschiedene Interneuron-Subtypen — und wie das epigenetische Profil mit transkriptomischen Änderungen verknüpft ist.
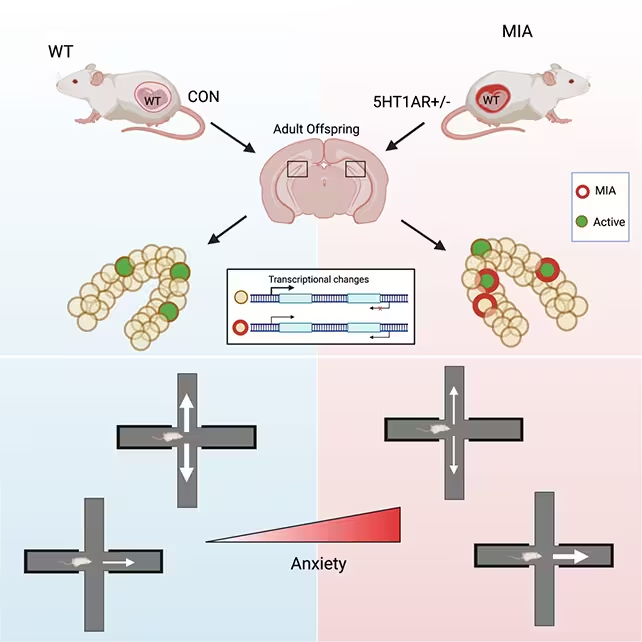
Mäuse, die im Mutterleib Stress ausgesetzt waren, zeigten als Erwachsene vermehrt ängstliches Verhalten.
Wissenschaftlicher Kontext und Bedeutung
Angststörungen gehören zu den weltweit häufigsten psychischen Erkrankungen; epidemiologische Erhebungen legen nahe, dass nahezu jede dritte Person im Verlauf ihres Lebens klinisch relevante Angst erlebt. Frühere Studien am Menschen und an Tieren haben bereits pränatale Einflüsse — wie mütterliche Infektionen, Ernährungszustand und Stress — mit erhöhten Raten von affektiven Störungen bei Nachkommen in Verbindung gebracht. Diese neue Mäusestudie beschreibt eine plausible mechanistische Abfolge: mütterliche Entzündung → gezielte epigenetische Veränderungen in einer Bedrohungsbewertungs-Schaltung → langfristige Übersensitivität gegenüber Stress und Vermeidungsverhalten.
Indem die Arbeit sowohl schaltungsbezogene Überaktivität als auch dazugehörige DNA-Methylierungsänderungen abbildet, trägt sie zu einer wachsenden Evidenz bei, dass frühe Umweltbedingungen die Gehirnfunktion durch stabile molekulare Markierungen programmieren können. Daraus ergibt sich die Aussicht, diagnostische Biomarker zu entwickeln — etwa epigenetische Signaturen, die in leicht zugänglichen Geweben nachweisbar sind — oder gezielte Therapien zu entwickeln, die maladaptive Schaltungspriming rückgängig machen.
Praktisch betrachtet könnte dies bedeuten, dass in Zukunft pränatale Risikofaktoren genauer erfasst werden und Frühinterventionen, etwa stressreduzierende Maßnahmen, immunmodulatorische Behandlungen oder gezielte neuromodulatorische Therapien, überprüft werden, um die langfristige psychische Gesundheit von Nachkommen zu verbessern.
Zukünftige Richtungen und Übersetzungsprobleme
Die Autorinnen und Autoren betonen wichtige Einschränkungen: Die Ergebnisse stammen aus kontrollierten Mausmodellen, und die Übertragung auf den Menschen erfordert Vorsicht. Zentrale offene Fragen sind, warum nur eine Untergruppe von vDG-Neuronen die epigenetischen Markierungen erhält und ob vergleichbare Methylierungssignaturen in peripheren Geweben erscheinen, die leichter abgenommen werden können (z. B. Blut, Plazenta oder Speichel).
Das Team plant, die Entwicklungsfenster zu kartieren, die für mütterliche Entzündungen besonders sensibel sind, und Interventionen zu testen, die vDG-Aktivität und Verhalten normalisieren könnten. Mögliche experimentelle Ansätze umfassen pharmakologische Modulation von Entzündungswegen während definierter Gestationsphasen, Einsatz von Opto- oder Chemogenetik zur gezielten Regulierung betroffener Neuronengruppen sowie epigenetische Editing-Strategien, um spezifische Methylierungsmuster zu verändern.
Auf dem Weg zur Anwendung beim Menschen gibt es jedoch mehrere Herausforderungen: Artunterschiede in der Gehirnorganisation, die Komplexität menschlicher Sozialisierung und Umweltfaktoren, ethische Fragen bezüglich pränataler Interventionen sowie technische Limitationen beim Nachweis zelltypspezifischer epigenetischer Signaturen in peripheren Proben. Außerdem ist die Frage, inwieweit epigenetische Veränderungen reversibel sind, noch nicht abschließend geklärt; manche Markierungen erscheinen stabil über lange Zeiträume, andere sind dynamisch und reagieren auf spätere Umwelteinflüsse.
Aus Public-Health-Perspektive unterstreicht die Studie dennoch die Bedeutung einer guten pränatalen Versorgung, effektiver Infektionskontrolle während der Schwangerschaft sowie psychosozialer Unterstützung für werdende Mütter. Selbst subtile Änderungen des gestationellen Umfelds können dauerhafte Veränderungen neuronaler Schaltungen bewirken, die sich über Jahrzehnte auf Verhalten und psychische Gesundheit auswirken.
Fachliche Einschätzung
"Diese Arbeit ist ein elegantes Beispiel dafür, wie pränatale Bedingungen spezifische neuronale Schaltkreise über epigenetische Mechanismen formen können", sagt Dr. Elena Vargas, eine Entwicklungsneurobiologin, die nicht an der Studie beteiligt war. "Auch wenn der Transfer auf menschliche Angststörungen nicht trivial ist, stärkt die Kombination aus Verhaltensassays, Schaltungsabbildung und DNA-Methylierungsprofilen in einer Studie die biologische Plausibilität. Zukünftige translationalen Schritte sollten sich darauf konzentrieren, periphere Biomarker zu identifizieren und therapeutische Zeitfenster für interventionelle Maßnahmen zu definieren."
Expertinnen und Experten heben hervor, dass Studien wie diese den Weg für interdisziplinäre Forschung ebnen: Molekularbiologen, Neurowissenschaftler, klinische Psychiater und Epidemiologen müssen zusammenarbeiten, um Mechanismen zu validieren, Biomarker zu testen und ethisch vertretbare Interventionsstrategien zu entwickeln.
Fazit
Die Studie der Weill Cornell bietet mechanistische Hinweise darauf, dass mütterliche Entzündung während der Schwangerschaft Nachkommen für erhöhte Angst sensibilisieren kann, indem eine diskrete Population von Neuronen im ventralen Dentatgyrus umprogrammiert wird. Obwohl die Befunde an Mäusen gewonnen wurden, verdeutlichen sie, wie pränatale Erfahrungen dauerhafte molekulare und schaltungsbezogene Spuren hinterlassen können, die das Verhalten beeinflussen. Weitere Forschung ist erforderlich, um zu klären, ob vergleichbare epigenetische Signaturen beim Menschen existieren und ob sie für Frühdiagnostik oder gezielte Therapien nutzbar sind, um das lebenslange Angstrisiko zu senken.
Insgesamt liefert die Arbeit wertvolle Einsichten in die Verknüpfung von Immunologie, Epigenetik und Neuroentwicklung — und betont zugleich die Notwendigkeit sorgfältiger, transdisziplinärer Forschung, bevor potenzielle klinische Anwendungen in Betracht gezogen werden.
Quelle: sciencealert

Kommentar hinterlassen