8 Minuten
Rheumatoide Arthritis (RA) kann sich oft lange bevor schmerzhafte Gelenkschwellungen oder sichtbare Entzündungen auftreten anbahnen. Aktuelle Forschungsergebnisse zeigen, dass charakteristische Veränderungen des Immunsystems — bereits Jahre vor dem Auftreten klinischer Synovitis im Blut nachweisbar — eine stille, präklinische Phase markieren, in der die Autoimmunaktivität sukzessive ansteigt. Das frühzeitige Erkennen solcher Biomarker könnte die Vorhersagegenauigkeit verbessern, frühzeitige therapeutische Eingriffe ermöglichen und dadurch das gelenkzerstörende Fortschreiten der RA begrenzen. In diesem Beitrag fassen wir die wichtigsten Erkenntnisse einer jüngsten Studie umfassend zusammen, erläutern biologische Mechanismen, bewerten die methodischen Ansätze und diskutieren klinische wie ethische Implikationen. So soll deutlich werden, wie translational verwertbare Signale im Blut die Brücke zwischen immunologischer Prädisposition und manifestem Gelenkentzündungsprozess bilden können.
Hintergrund: stille Autoimmunität und ACPAs
Die rheumatoide Arthritis ist eine chronisch-entzündliche Autoimmunerkrankung, bei der das Immunsystem körpereigene Strukturen in den Gelenken angreift und dadurch anhaltende Entzündungen, Schmerzen sowie irreversible Gelenkschäden verursacht. Klinisch erkennbare Gelenkentzündungen werden als Synovitis bezeichnet und sind häufig das Symptom, das Patientinnen und Patienten zur ärztlichen Abklärung bringt. Vor dem Auftreten von Synovitis existiert jedoch häufig eine längere, symptomfreie Phase: Manche Personen weisen schon Jahre zuvor spezifische Autoantikörper im Blut auf, die sogenannten anticitrullinierten Proteinantikörper (ACPAs).
ACPAs entstehen als Reaktion auf citrullinierte Proteine — Proteine, bei denen Arginin-Reste enzymatisch in Citrullin umgewandelt wurden. Diese Modifikation kann die Immunerkennung verändern und zur Bildung von Autoantikörpern führen. ACPA-Positivität gilt als früher Marker für autoimmune Sensibilisierung und ist mit einem erhöhten Risiko für die Entwicklung einer RA assoziiert. Wobei wichtig bleibt: Nicht alle ACPA-positiven Personen entwickeln zwangsläufig eine klinische RA. Das heißt, ACPA allein ist ein indirekter Risikomarker, dessen Vorhersagekraft durch zusätzliche immunologische und klinische Parameter verbessert werden muss.
Zu den weiteren Einflussfaktoren, die das Fortschreiten von stiller Autoimmunität zur manifesten Krankheit fördern können, zählen genetische Dispositionen (beispielsweise Varianten im HLA-DRB1-Gen, das sogenannte "shared epitope"), Umweltfaktoren wie Tabakrauch, sowie lokale Prozesse an mucosalen Oberflächen (z. B. Lunge, Mundschleimhaut) mit entzündlichen Veränderungen und lokaler Proteinmodifikation. Diese multifaktorielle Entstehung macht deutlich, warum ein einzelner Marker selten ausreicht und warum die Identifikation kombinierter Signaturen — Proteine, Zelltypen und funktionelle Eigenschaften — für eine verlässliche Risikostratifizierung erforderlich ist.
Studiendesign und Methoden
Ein interdisziplinäres Forschungsteam aus dem Allen Institute for Immunology, der University of California San Diego und der University of Colorado Anschutz verfolgte eine Kohorte von Menschen mit ACPA-Positivität, um die zeitliche Abfolge immunologischer Veränderungen vor dem Auftreten klinischer RA zu untersuchen. Die Kohorte umfasste 45 Personen, die aufgrund ihres serologischen Profils als "at risk" eingestuft wurden; von diesen entwickelten 16 Probandinnen und Probanden während des Beobachtungszeitraums eine klinisch manifeste RA. Zusätzlich wurden Daten gesunder Kontrollpersonen herangezogen, um Referenzprofile zu erstellen.
Methodisch verbanden die Autoren mehrere komplementäre Ansätze: hochauflösende Blutproteomik zur quantitativen Erfassung entzündlicher Proteine; detaillierte zelluläre Profilierung, einschließlich einzelzellbasierter Analysen, um Subpopulationen von B- und T-Zellen zu identifizieren; sowie funktionelle Tests, die die Reaktionsbereitschaft, die Antikörperproduktion und die T-Zell-Aktivierung bewerteten. Durch die Kombination dieser Datenquellen entstand eine mehrdimensionale Zeitachse immunologischer Aktivierung in der präklinischen Phase. Statistische Modellierungen und longitudinale Vergleiche zwischen jenen, die später RA entwickelten (Progressoren), und jenen, die dies nicht taten (Nicht-Progressoren), halfen dabei, robuste Muster und prädiktive Signaturen herauszufiltern.
Wichtig für die Aussagekraft solcher Studien sind auch Standardisierung und Validierung: Reproduzierbare Assays, korrekte Kalibrierung biochemischer Tests und die Kontrolle für konfoudierende Faktoren (Alter, Geschlecht, Begleiterkrankungen, Medikation) sind Voraussetzung, um klinisch relevante Schlussfolgerungen ziehen zu können. Die hier berichteten Befunde beruhen auf kombinierten Messungen, die immunologische Breite abdecken — von Zytokin- und Chemokinprofilen bis zu differenzierten Lymphozytensubtypen — und damit ein breiteres Bild der immunologischen Dynamik vermitteln.
Wesentliche Entdeckungen
Die Untersuchung zeigte einen deutlichen Anstieg entzündlicher Proteine und eine verstärkte Immunaktivität in der Gruppe der ACPA-positiven Teilnehmenden gegenüber Kontrollen. Insbesondere waren Proteine, die sowohl mit angeborenen als auch mit adaptiven Immunwegen assoziiert sind — etwa verschiedene Interleukine, Chemokine, Akute-Phase-Proteine sowie Komplementfaktoren — häufiger und in verstärkter Form nachweisbar. Solche Muster sprechen für eine systemische Aktivierung des Immunsystems noch bevor Gelenksymptome auftreten.
Auf Ebene der Immunzellen zeigte sich eine Verschiebung in Richtung eines „primed“ Phänotyps: B-Zellen, darunter aktivierte Gedächtnis-B-Zellen und plasmablastenähnliche Zellen, schienen häufiger vorkommen oder eine erhöhte Funktionsbereitschaft zu besitzen. Parallel dazu veränderte sich die Zusammensetzung der T-Zell-Populationen: Subtypen, die bei gesunden Personen typischerweise regulatorische oder weniger entzündliche Funktionen ausüben, zeigten Anzeichen funktioneller Umprogrammierung hin zu proinflammatorischen Profilen. Solche Veränderungen können die autoreaktive Antikörperproduktion befördern und lokale entzündliche Prozesse in Gelenken begünstigen.
Funktionelle Tests belegten, dass B-Zellen aus „at-risk“-Personen eine stärkere Tendenz zur Produktion autoreaktiver Antikörper zeigten und dass T-Zellen verstärkt Hilfsfunktionen für B-Zellen übernehmen konnten. Diese Interaktion von B- und T-Zellen ist zentral für die Expansion autoreaktiver Klone und die Etablierung einer selbstverstärkenden Autoimmunantwort. Gleichzeitig zeigten die Daten heterogene Verläufe: Es bestand eine Überschneidung von Immunmarkern zwischen Progressoren und Nicht-Progressoren, sodass einzelne Marker allein nicht ausreichen. Die kombinierte Signatur aber — Proteomik plus Zellphänotypen und funktionelle Parameter — liefert ein klareres Bild der biologischen Evolution von stiller Autoimmunität hin zur klinischen RA.
Die Autorinnen und Autoren fassen zusammen, dass die entzündliche Erkrankung RA deutlich vor dem klinischen Auftreten aktiver Synovitis beginnt, also früher als klinisch bislang oft angenommen. Diese Erkenntnis verschiebt das Verständnis von RA hin zu einem graduellen, über Jahre verlaufenden Prozess mit klaren, messbaren immunologischen Veränderungen.
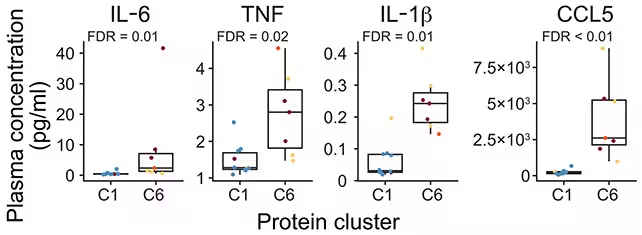
Entzündliche Proteine wurden als gehäuft in einer Gruppe festgestellt, die überwiegend aus Personen bestand, die ein Risiko für Arthritis aufwiesen (C6). (He et al., Sci. Transl. Med., 2025)
Auswirkungen auf Diagnose und Therapie
Die Kenntnis, welche immunologischen Signale einer Progression zur RA vorausgehen, eröffnet mehrere klinisch relevante Möglichkeiten. Zunächst könnten kombinierte Biomarker-Panels aus Entzündungsproteinen und Immunzell-Markern die Risikostratifizierung bei ACPA-positiven Personen deutlich verfeinern. Ein solcher multidimensionaler Ansatz würde ermöglichen, zwischen hoher und niedriger Progressionswahrscheinlichkeit zu unterscheiden und so sowohl Übertherapie als auch Unterdiagnose zu vermeiden. In der Praxis könnte dies bedeuten, dass Personen mit hoher Risikokonstellation enger überwacht oder in Studien zu präventiven Interventionen eingeschlossen werden.
Zweitens eröffnet die präklinische Phase ein therapeutisches Zeitfenster: Wenn interventive Maßnahmen vor der Entstehung irreversibleer Gelenkschäden greifen, steigt die Chance, die Krankheitslast zu reduzieren. Das immunmodulatorische Medikament Abatacept, das die T-Zell-Kostimulation moduliert, wird bereits in bestimmten Hochrisikogruppen untersucht und zeigt Hinweise darauf, dass es Aspekte der hier gefundenen Immunaktivierung umkehren kann. Solche Beobachtungen stützen die Idee, dass gezielte Therapien vor dem vollständigen Ausbruch wirksam sein können. Dennoch bedarf es randomisierter Studien, um Wirksamkeit, Dauertherapie, Sicherheitsprofil und Kosten-Nutzen-Verhältnis zu klären.
Neben pharmakologischen Optionen spielen auch nicht-medikamentöse Maßnahmen eine Rolle: Lebensstilinterventionen (z. B. Raucherentwöhnung), Behandlung von entzündlichen Prozessen an mucosalen Oberflächen und die Kontrolle komorbider Entzündungsquellen könnten synergistisch wirken, um die Progression zu verzögern. Zudem sind ethische und praktische Fragen zu beachten: Soll man asymptomatische Personen behandeln? Welche Risiken sind vertretbar? Wie lassen sich Screening-Programme wirtschaftlich sinnvoll organisieren? Antworten darauf benötigen valide Biomarker, reproduzierbare Tests und klare klinische Leitlinien.
Kevin Deane, Rheumatologe an der CU Anschutz, wird vom Studienteam zitiert mit der Einschätzung, dass die Ergebnisse «zusätzliche Studien unterstützen könnten … um besser vorherzusagen, wer RA bekommen wird, potenzielle biologische Ziele zur Verhinderung von RA zu identifizieren sowie Wege zu finden, Behandlungen zu verbessern.» Diese Perspektive betont die Translation: Grundlagenbefunde sollen in praktikable Strategien für Prävention und personalisierte Therapie überführt werden.
Fazit
Die hier zusammengefasste Forschung zeichnet ein Bild einer präklinischen Phase der rheumatoiden Arthritis, die durch steigende Entzündungsmarker im Blut sowie eine zunehmende Aktivierung und Funktionalisierung von B- und T-Zellen charakterisiert ist. Die Identifikation solcher Frühsignale bietet die Aussicht, von reaktiven zu proaktiven Strategien im Umgang mit RA überzugehen. Bevor jedoch breite klinische Anwendungen implementiert werden, sind mehrstufige Validierungen, prospektive Interventionsstudien und die Entwicklung standardisierter, kosteneffizienter Tests notwendig.
Langfristig könnten validierte Biomarker-Algorithmen dazu beitragen, individuelle Risikoabschätzungen zu verbessern, gezielte Präventionsstudien durchzuführen und so das Auftreten von Schmerz, Funktionsverlust und Behinderung infolge RA zu reduzieren. Entscheidend bleibt ein ausgewogener Umgang mit möglichen Vorteilen und Risiken — einschließlich ethischer Fragen zur Behandlung asymptomatischer Menschen — sowie eine internationale Zusammenarbeit zur Harmonisierung von Methoden und Leitlinien.
Quelle: sciencealert

Kommentar hinterlassen