8 Minuten
Stammzellinjektionen kehren Schlaganfallschäden in Mausgehirnen um
Forscherinnen und Forscher der Universität Zürich und der University of Southern California berichten, dass transplantierte humane Stammzellen in Mausmodellen geschädigtes Hirngewebe nach ischämischem Schlaganfall reparieren können. In einem präklinischen Modell überlebten injizierte Stammzellen, differenzierten sich zu neuronähnlichen Zellen und bildeten Verbindungen zum Wirtsgewebe. Die in Nature Communications publizierte Studie beschreibt eine multifaktorielle regenerative Antwort: neuronale Differenzierung, vaskuläre Reparatur, Verringerung von Entzündungsprozessen und eine gestärkte Integrität der Blut‑Hirn‑Schranke. Diese zellulären und vaskulären Effekte gingen mit messbaren Verbesserungen der motorischen Koordination der behandelten Tiere einher, was die funktionale Relevanz der Befunde unterstreicht.
Wissenschaftlicher Hintergrund und experimenteller Ansatz
Ein Schlaganfall entsteht durch Blutungen im Gehirn oder durch Sauerstoffmangel infolge verstopfter Blutgefäße und führt zum Absterben von Nervenzellen sowie häufig zu dauerhaften Defiziten in Sprache, Motorik und Kognition. Während aktuelle klinische Interventionen vor allem auf die Begrenzung akuter Schäden und auf Rehabilitation abzielen, verfolgen regenerative Ansätze das Ziel, verlorenes neuronales Gewebe zu ersetzen oder wiederherzustellen. In der vorliegenden Studie verwendeten die Forschenden Mäuse mit schlaganfallbedingten Läsionen und injizierten humane neurale Stammzellen in die betroffenen Hirnregionen, nachdem die akute Phase stabilisiert war. Die Festlegung des optimalen Zeitfensters für die Transplantation ist dabei entscheidend: Frühere Arbeiten desselben Teams zeigten, dass das verletzte Gehirn erst ein bestimmtes Stabilitätsniveau erreichen muss, damit die Anwachsung (Engraftment) der transplantierten Zellen erfolgreich ist und funktionelle Integration möglich wird.
Als Modell wurde typischerweise die mittlere Hirnarterienverschluss‑Methode (middle cerebral artery occlusion, MCAO) eingesetzt, ein gut etabliertes präklinisches Paradigma zur Nachbildung ischämischer Schlaganfälle. Die Untersuchung kombinierte immunhistochemische Analysen, molekulare Marker und funktionelle Tests über einen Nachbeobachtungszeitraum von fünf Wochen. Die Forschenden verfolgten die implantierten Zellen systematisch: Der Großteil der Zellen blieb lokalisiert in der Nähe der Injektionsstelle, zeigte morphologische und molekulare Kennzeichen unreifer Neurone und bildete Ausläufer, die Kontakt zu residenten Neuronen und lokalen Schaltkreisen herstellten. Parallel beobachteten die Autorinnen und Autoren vaskuläres Remodeling – Blutgefäße wiesen Zeichen eigenständiger Reparatur auf – sowie eine Verringerung von Entzündungsmarkern und eine Verbesserung der Eigenschaften der Blut‑Hirn‑Schranke, wodurch ein Umfeld entstand, das Wiederherstellung und Netzwerkintegration begünstigt.
Zentrale Entdeckungen und Konsequenzen für die Schlaganfall‑Rehabilitation
Die wichtigsten Ergebnisse lassen sich in drei Punkten zusammenfassen: Erstens können eingebrachte humane neurale Stammzellen in einem geschädigten erwachsenen Gehirn überleben und sich zu neuronähnlichen Zellen differenzieren. Zweitens sind diese Zellen in der Lage, sich strukturell zu integrieren und synaptische Kontakte mit dem Wirtsgewebe zu formen. Drittens löst die Transplantation offenbar sekundäre regenerative Prozesse aus, darunter Angiogenese (Reparatur und Neubildung von Blutgefäßen) sowie Immunmodulation. Solche Kombinationseffekte sind für die funktionale Wiederherstellung besonders relevant, weil die neuronale Integration allein häufig nicht ausreicht, wenn Mikroumgebungsfaktoren wie Entzündung und Gefäßschutz nicht ebenfalls adressiert werden.
Funktionell zeigten behandelte Mäuse eine deutlich bessere motorische Leistung im Vergleich zu Kontrollen, gemessen an standardisierten Verhaltenstests zur Koordinations- und Bewegungsfähigkeit. Diese Unterschiede sind translational bedeutsam, weil motorische Defizite zu den schwerwiegendsten und langanhaltendsten Konsequenzen eines Schlaganfalls gehören. Die Studienergebnisse stützen damit die Hypothese, dass zellbasierte Therapien nicht nur zellulär überleben müssen, sondern auch netzwerkrelevante Konnektivität und günstige immun-vascularen Mikroenvironment fördern sollten, um klinisch relevante Verbesserungen zu erzielen.
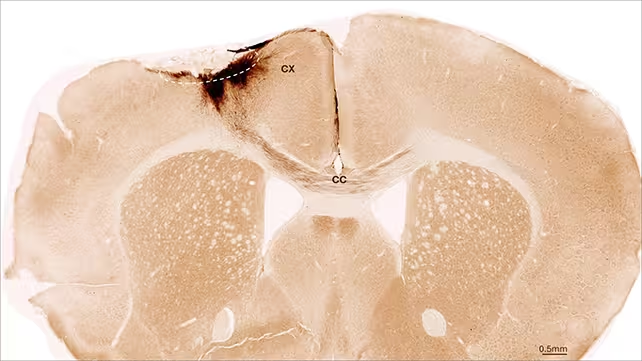
Diese Ergebnisse verstärken das Konzept, dass zellbasierte Therapien eines Tages Funktionen wiederherstellen könnten, die heute als irreversibel gelten. Gleichzeitig machen sie deutlich, dass bei der Bewertung regenerativer Strategien für das zentrale Nervensystem mehrere Messgrößen kombiniert werden müssen: Zellüberleben, morphologische und funktionelle Konnektivität, vaskuläre Gesundheit, Entzündungsstatus und Verhaltensänderungen. Nur eine integrative Analyse dieser Parameter erlaubt eine realistische Einschätzung des therapeutischen Potenzials.
Herausforderungen, Sicherheit und Weg zur klinischen Translation
Trotz vielversprechender präklinischer Daten bestehen vor dem Einsatz am Menschen mehrere Hürden. Die langfristige Sicherheit muss eindeutig belegt werden: implantierte Zellen dürfen sich nicht unkontrolliert vermehren, tumorös wachsen oder in unerwünschte Regionen migrieren. Optimale Applikationswege (z. B. intrazerebrale Injektion versus intravaskuläre Verabreichung), Dosierung und präzise Zeitfenster der Transplantation bedürfen weiterer Optimierung, weil diese Parameter die Überlebensrate, Differenzierung und Integration der Zellen maßgeblich beeinflussen. Zudem sind Immunverträglichkeit, mögliche Xenotransplantations‑Aspekte und die Skalierung von Maus- zu menschlichem Gehirn – mit seiner größeren Größe, differenzierten Architektur und komplexeren Schaltkreisen – erhebliche Übersetzungsbarrieren.
Technisch kommen zusätzliche Fragen hinzu: Welche Subtypen neuraler Stammzellen sind am geeignetsten (z. B. pluripotente Stammzell‑abgeleitete Vorläuferzellen versus epigenetisch vorkonditionierte neurale Vorläufer)? Muss die Transplantation von einer immunsuppressiven Therapie begleitet werden, und wenn ja, wie lange? Welche Rolle spielen Endothelzellen, Perizyten und Astrozyten — also die zelluläre Umgebung — für die erfolgreiche Integration? Schließlich verlangen regulatorische Behörden für Stammzellprodukte umfangreiche, oft mehrjährige Sicherheits‑ und Wirksamkeitsstudien, inklusive GLP‑konformer Toxizitätsprüfungen und prospektiver klinischer Prüfphasen (Phase I–III), bevor eine Zulassung möglich ist.
Das Forschungsteam mahnt daher zur Vorsicht bei gleichzeitiger begründeter Zuversicht. Laut den leitenden Wissenschaftlerinnen und Wissenschaftlern gehen ihre Analysen über unmittelbare posttransplantative Effekte hinaus und prüfen, ob die neu entstehenden Zellen tatsächlich neurologische Verbindungen bilden — ein zentrales Kriterium, um bedeutsame funktionelle Erholung sicherzustellen. Darüber hinaus plädieren die Autorinnen und Autoren für ergänzende Langzeitstudien, in denen sowohl molekulare Marker als auch Verhaltenstests über Monate bis Jahre verfolgt werden müssen, um potenzielle Spätwirkungen zu identifizieren.
Expertinnen‑ und Experteneinschätzung
Dr. Maria Alvarez, eine fiktive Spezialistin für Neuroregeneration, kommentiert: „Diese Studie ist bedeutsam, weil sie nicht nur das Überleben der Zellen dokumentiert, sondern auch deren Integration und die begleitende Reparatur des umliegenden Gewebes. Diese Kombination — Neurogenese plus vaskuläre und immunologische Modulation — könnte essenziell für dauerhafte funktionelle Erholung sein. Dennoch erfordert die Translation dieser Ergebnisse die Lösung praktischer Probleme wie Immunabstoßung, langfristige Überwachung und die Gewährleistung, dass die transplantierten Zellen in menschlichen neuronalen Netzwerken funktionell angemessen agieren.“
Solche Expertinnen‑ und Expertenkommentare heben hervor, dass erfolgreiche klinische Anwendungen multidisziplinäre Ansätze benötigen: Zellbiologen, Neurochirurgen, Neurologen, Immunologen und Regulatorik‑Experten müssen zusammenarbeiten, um sichere und wirksame Therapieprotokolle zu entwickeln. Von besonderer Bedeutung sind standardisierte Qualitätskriterien für Zellprodukte, robuste In‑vitro‑Charakterisierungen vor der Transplantation sowie Nachbeobachtungsprogramme für klinische Studienpatienten, die sowohl neuropathologische als auch neuropsychologische Endpunkte berücksichtigen.
Schlussfolgerung
Die hier präsentierte Studie liefert belastbare präklinische Hinweise darauf, dass humane neurale Stammzellen sich einnisten, differenzieren und Reparaturprozesse in schlaganfallgeschädigten Mausgehirnen fördern können. Zu den beobachteten Effekten zählen neuronale Integration, vaskuläre Selbstreparatur, reduzierte Entzündungsreaktionen und verbesserte motorische Funktionen. Solche kombinierten zellulären und gewebebezogenen Mechanismen erhöhen die Wahrscheinlichkeit, dass künftige regenerative Therapien tatsächlich klinisch relevante Verbesserungen für Schlaganfallpatientinnen und -patienten bringen könnten.
Gleichwohl bleibt der Weg zur klinischen Anwendung anspruchsvoll: Es bedarf verlängerter Sicherheitsstudien, einer Optimierung von Zeitfenstern und Verabreichungswegen, sowie sorgfältig geplanten klinischen Tests, die schrittweise die Sicherheit und Wirksamkeit in Menschen belegen. Insgesamt ergänzt diese Arbeit ein wichtiges Kapitel in der regenerativen Neurologie und macht deutlich, wie integrierte Reparaturmechanismen auf zellulärer und Gewebeebene eines Tages Funktionen wiederherstellen könnten, die durch Schlaganfälle verloren gegangen sind.
Für die wissenschaftliche Gemeinschaft, klinische Studiengruppen und Gesundheitsbehörden liefert die Publikation sowohl Anhaltspunkte für die Machbarkeit als auch eine Roadmap für weiterführende Untersuchungen. Zukünftige Forschungsrichtungen umfassen die Optimierung von Zellentypen und -zuständen, die Entwicklung weniger invasiver Liefermethoden (z. B. intravaskuläre homing‑strategien), gentherapeutische Vorkonditionierung zur Verbesserung der Engraftment‑Rate sowie kombinierte Therapieansätze, bei denen Stammzelltransplantation mit angiogenen oder immunmodulierenden Medikamenten koordiniert wird. Solche kombinierten Strategien könnten die Basis für die nächste Generation von Schlaganfalltherapien bilden.
Quelle: sciencealert

Kommentar hinterlassen