8 Minuten
Studienüberblick und Schlüsselbild
Eine neue Studie des Florey Institute of Neuroscience and Mental Health in Melbourne berichtet, dass eine SARS‑CoV‑2‑Infektion bei männlichen Mäusen messbare Veränderungen im Sperma hervorrief, die mit verstärkten angstähnlichen Verhaltensweisen bei ihren Nachkommen assoziiert waren. Die peer‑reviewten Ergebnisse, veröffentlicht in Nature Communications, beschreiben molekulare Veränderungen in Sperma‑RNA und anhaltende Modifikationen der Genaktivität im Gehirn, die auf epigenetische Vererbung hinweisen könnten. Diese Arbeit erweitert die Diskussion über transgenerationale Effekte von Infektionen und fügt dem Forschungsfeld zu epigenetischer Vererbung und Sperma‑RNA bei Säugetieren neue experimentelle Daten hinzu.
Die Autoren betonen, dass es sich um ein streng kontrolliertes Tiermodell handelt, das gezielt mechanistische Fragen adressiert: Welche molekularen Signale werden durch eine väterliche Infektion verändert, und wie könnten diese Signale die Entwicklung des ZNS der Nachkommen beeinflussen? Solche Fragen sind sowohl für Grundlagenforschung zu epigenetischen Mechanismen als auch für längerfristige öffentliche‑gesundheitliche Überlegungen relevant, weil sie mögliche Wege aufzeigen, wie Umweltfaktoren und Infektionserkrankungen bei Eltern die Gesundheit der nächsten Generation beeinflussen können.
„Wir fanden, dass die Nachkommen der infizierten Väter im Vergleich zu Nachkommen nicht infizierter Väter ein stärker ausgeprägtes Angstverhalten zeigten,“ erklärte Elizabeth Kleeman, Erstautorin der Studie. Co‑Seniorautorin Carolina Gubert ergänzte, dass veränderte Genaktivität im Hippokampus — einer zentralen Hirnregion für Emotionsregulation und Gedächtnis — eine plausible Erklärung für die beobachteten Verhaltensänderungen liefern könnte. Die formale Interpretation der Daten stützt sich auf kombinierte Verhaltensanalysen, RNA‑Profiling und Gehirntranskriptomik.
Experimentelles Design und molekulare Befunde
Im experimentellen Aufbau wurden erwachsene männliche Mäuse dem Virus ausgesetzt, das COVID‑19 verursacht, und nach einer definierten Erholungsphase mit nicht infizierten Weibchen verpaart. Die Forscher verfolgten anschließend Gesundheit, Verhalten und Genexpression im Gehirn der resultierenden Würfe über festgelegte Zeitpunkte. Standardisierte Verhaltensprüfungen — darunter offene Feld‑ und erhöhte Plus‑Labyrinthe — zeigten bei allen Nachkommen infizierter Väter erhöhte angstähnliche Reaktionen. Die Arbeitsgruppe nutzte etablierte Verhaltensparadigmen, um reproduzierbare, quantifizierbare Unterschiede zu erfassen.
Auf molekularer Ebene identifizierte die Studie spezifische Modifikationen in Sperma‑RNA nach der Infektion. Zu den veränderten RNA‑Spezies gehörten insbesondere kleine nicht‑kodierende RNAs wie microRNAs (miRNAs), tRNA‑Fragmente (tRFs) und andere kurze RNA‑Fraktionen, die in früheren Studien mit der Regulation von Gennetzwerken in der neuronalen Entwicklung in Verbindung gebracht wurden. Einige dieser spermiengetragenen RNA‑Moleküle sind bekannt dafür, Gene zu beeinflussen, die während früher Stadien der Gehirnentwicklung aktiv sind, etwa solche, die neuronale Differenzierung, Synaptogenese und Stressreaktionen steuern.
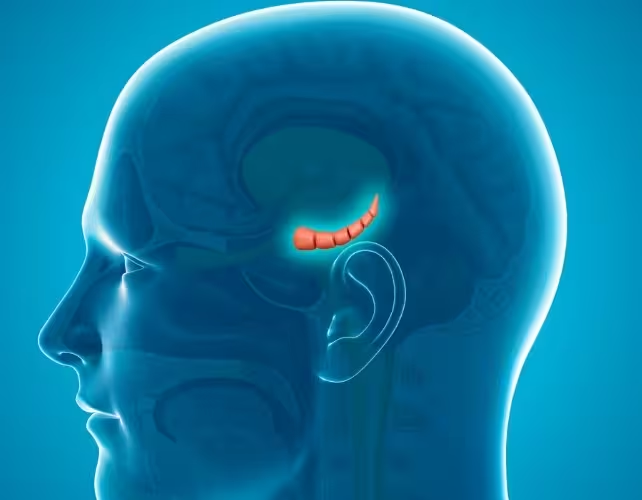
Der Hippokampus (Mitte) im menschlichen Gehirn
Die Transkriptom‑Analysen des Hippokampus bei weiblichen Nachkommen zeigten „signifikante Veränderungen“ in Mustern der Genexpression. Carolina Gubert fasste zusammen: „Dies könnte zur erhöhten Ängstlichkeit beitragen, die wir bei den Nachkommen beobachtet haben, über epigenetische Vererbung und veränderte Hirnentwicklung.“ Leitender Forscher Anthony Hannan wies auf die mögliche Breitenwirkung hin: „Diese Ergebnisse deuten darauf hin, dass die COVID‑19‑Pandemie langfristige Effekte auf nachfolgende Generationen haben könnte.“ Gleichzeitig mahnte er Vorsicht an: Ob diese Mechanismen in gleicher Weise beim Menschen auftreten, ist gegenwärtig nicht belegt und erfordert weitere Untersuchungen.
Wissenschaftlicher Kontext und Implikationen
Der Begriff epigenetische Vererbung umfasst Veränderungen, die nicht die DNA‑Sequenz selbst betreffen — etwa chemische Markierungen an DNA (z. B. Methylierung), histonmodifizierende Muster oder unterschiedliche RNA‑Inhalte in Keimzellen — und die dennoch die Genexpression bei Nachkommen beeinflussen können. Tierexperimentelle Studien haben bereits gezeigt, dass Umweltfaktoren wie Stress, Ernährung, Toxine oder Infektionen Spermienepigenetik verändern und dadurch phänotypische Merkmale in der nächsten Generation modulieren können. Die hier vorgestellte Studie ergänzt die Liste um eine kontrollierte SARS‑CoV‑2‑Infektion in einem Mäusemodell und liefert damit experimentelle Belege, dass virale Krankheiten solche Effekte hervorrufen können.
Wenn vergleichbare Prozesse beim Menschen stattfinden, wären die gesundheitspolitischen Auswirkungen potenziell weitreichend: Weltweit wurden während der Pandemie Millionen Menschen infiziert, und transgenerationale Effekte würden die biologische Spur der Pandemie über die unmittelbar Erkrankten hinaus verlängern. Solche Perspektiven betreffen nicht nur Neurowissenschaft und Entwicklungsbiologie, sondern auch öffentliche‑gesundheitliche Planung, Reproduktionsmedizin und präventive Strategien zur Risikominderung.
Gleichwohl ist besondere Vorsicht geboten: Es bestehen grundlegende Unterschiede zwischen Maus‑ und menschlicher Keimbahn‑Biologie, Entwicklungszeitplänen und Umwelteinflüssen. Epidemiologische Belege, die eine direkte Verbindung zwischen elterlicher COVID‑19‑Infektion und veränderter Neuroentwicklung bei Kindern herstellen, fehlen bislang oder sind noch unzureichend, da umfangreiche, gut kontrollierte Kohortenstudien erforderlich sind. Die Studie liefert somit wichtige mechanistische Hypothesen, aber keine unmittelbare Grundlage für klinische Schlussfolgerungen beim Menschen.
Nächste Schritte und Forschungsschwerpunkte
Zukünftige Forschung sollte mehrere komplementäre Fragestellungen adressieren: Erstens, ob vergleichbare Veränderungen in Sperma‑RNA und anderen epigenetischen Markern auch bei infizierten Männern auftreten, zweitens, ob diese Signale über längere Zeiträume stabil bleiben oder sich mit der Erholungsphase des Vaters verändern, und drittens, wie solche paterna‑len Signale mit maternalen Effekten und postnatalen Umwelteinflüssen interagieren. Längerfristige, prospektive Kohortenstudien — einschließlich semenanalytischer Untersuchungen und epigenetischer Profilierung bei Männern vor und nach einer SARS‑CoV‑2‑Infektion — könnten hier wichtige epidemiologische Hinweise liefern.
Auf mechanistischer Ebene sind molekularbiologische Experimente notwendig, um Kausalzusammenhänge zu prüfen: Beispielsweise könnten isolierte spermien‑assoziierte RNAs transferiert werden, um direkt zu testen, ob sie Entwicklungsprogramme im Embryo beeinflussen und zu den beobachteten Verhaltensphänotypen führen. Solche Transferexperimente, kombiniert mit gezielten Knockdown‑ oder Overexpression‑Ansätzen, würden die Beweiskette zwischen Sperma‑RNA‑Veränderungen und funktionellen Effekten im Gehirn der Nachkommen stärken oder schwächen.
Darüber hinaus sollten Untersuchungen zu möglichen biologischen Mechanismen — etwa Veränderungen der DNA‑Methylierung, Histonmodifikationen, Chromatin‑Struktur oder die Rolle extrazellulärer Vesikel — in Sperma und frühen Embryonen integriert werden. Interdisziplinäre Zusammenarbeit zwischen Reproduktionsbiologen, Neurowissenschaftlern, Epidemiologen und klinischen Forschern ist entscheidend, um die Tragweite der Befunde für die menschliche Gesundheit realistisch einzuschätzen.
Technische Details und methodische Überlegungen
Die Studie verwendete moderne Hochdurchsatzsequenzierung, um RNA‑Profile aus Spermapräparaten zu gewinnen, sowie Transkriptomanalysen des Hippokampus durch RNA‑Seq. Solche Daten erfordern sorgfältige Bioinformatik‑Pipelines, um Unterschiede in kurzen RNA‑Klassen wie miRNAs oder tRFs sicher zu identifizieren und technische Artefakte auszuschließen. Wichtig sind Kontrollen für Spermienreinheit, mögliche Beiträge von Somazellen oder Restwasser und Validierung durch unabhängige Methoden wie qPCR oder Northern‑Blots für signifikante Kandidaten.
Auf Verhaltensebene ist die Reproduzierbarkeit von Bedeutung: Verhaltenstests sind sensitiv gegenüber Umgebungsvariablen wie Laborbedingungen, Versuchszeitpunkt und handhabungsbedingtem Stress. Die Autoren berichten von konsistenten Ergebnissen über verschiedene Testparadigmen hinweg, was die Robustheit der Befunde unterstützt. Trotzdem bleibt es wichtig, Ergebnisse in unabhängigen Tierkolonien und unterschiedlichen Mauslinien zu replizieren, um genetische Hintergrundeffekte auszuschließen.
In Bezug auf humane Übersetzbarkeit sind zudem Unterschiede im Lebenszyklus, in der Spermienreifung und in der Entwicklungszeit zu berücksichtigen. Menschliche Studien müssten confounder wie Alter, Komorbiditäten, Impfstatus, Schwere der Infektion und sozioökonomische Faktoren berücksichtigen, die ebenfalls die Keimbahn‑Epigenetik und kindliche Entwicklung beeinflussen können.
Gesellschaftliche und ethische Aspekte
Die Möglichkeit, dass Infektionskrankheiten transgenerationale Effekte haben, wirft ethische und gesellschaftliche Fragen auf: Wie kommuniziert man solche wissenschaftlichen Unsicherheiten an die Öffentlichkeit, ohne unbegründete Angst zu schüren? Welche Konsequenzen ergeben sich für präventive Gesundheitsstrategien, reproduktionsmedizinische Beratung oder öffentliche Gesundheitspolitik? Transparente, evidenzbasierte Kommunikation ist zentral, damit wissenschaftliche Ergebnisse angemessen kontextualisiert werden und nicht zu Stigmatisierung oder falschen Schlussfolgerungen führen.
Forscher und Kliniker sollten bei der Übersetzung tierexperimenteller Befunde in Empfehlungen für Menschen sensibel vorgehen. Interdisziplinäre Ethik‑Boards und Stakeholder‑Dialoge mit Betroffenenvereinigungen können helfen, wissenschaftliche Evidenz, klinische Praxis und gesellschaftliche Werte miteinander in Einklang zu bringen.
Fazit
Die Studie aus Melbourne liefert experimentelle Evidenz im Mausmodell, dass eine väterliche SARS‑CoV‑2‑Infektion den molekularen Inhalt von Spermien verändern kann und diese Veränderungen mit Angst‑ähnlichen Abweichungen in Gehirnfunktion und Verhalten der Nachkommen zusammenfallen. Die Ergebnisse erweitern unser Verständnis von möglichen transgenerationalen Konsequenzen von Infektionskrankheiten und sensibilisieren für die Rolle von Sperma‑RNA und epigenetischen Mechanismen in der Entwicklungsbiologie.
Gleichzeitig sind die Befunde kein direkter Beleg für analoge Effekte beim Menschen: Bestätigende, gut designte longitudinale Studien sowie mechanistische Arbeiten am Menschen sind notwendig, um klinische Relevanz und mögliche gesundheitspolitische Maßnahmen zu beurteilen. Kurzfristig sind die wichtigsten Schritte, humane Daten zu generieren, molekulare Mechanismen weiter aufzuklären und die Übersetzung tierexperimenteller Ergebnisse in sinnvolle, evidenzbasierte Empfehlungen sorgfältig vorzunehmen. Insgesamt unterstreicht die Arbeit die Notwendigkeit interdisziplinärer Forschung zu COVID‑19, Epigenetik, Sperma‑RNA und transgenerationalen Auswirkungen auf die psychische Gesundheit. Schlüsselbegriffe in diesem Kontext sind epigenetische Vererbung, Sperma‑RNA, Hippokampus, Angstverhalten, SARS‑CoV‑2 und transgenerationale Effekte.
Quelle: sciencealert

Kommentar hinterlassen