7 Minuten
Forscher berichten über ein kleines, gentechnisch verändertes Peptid, das das mit Parkinson assoziierte Protein Alpha‑Synuclein in seiner normalen Konformation hält und so dessen Fehlfaltung und das anschließende Verklumpen verhindert, die als schädlich für Nervenzellen gelten. In einem einfachen Wurmmodell getestet, zeigt das Molekül eine gute Resistenz gegenüber intrazellulärem Abbau und beeinträchtigt nicht die gesunde Rolle von Alpha‑Synuclein bei der Neurotransmission. Diese Eigenschaften deuten auf einen vielversprechenden, frühen Ansatz hin, Proteinaggregation bereits im Entstehungsstadium zu stoppen, bevor sie toxisch wird.
Ein winziges Peptid, das Alpha‑Synuclein fixiert
Alpha‑Synuclein ist ein kleines, neuronales Protein, das am Feinabgleich der Freisetzung von Dopamin und anderen Neurotransmittern beteiligt ist und insbesondere in dopaminergen Neuronen eine zentrale Rolle spielt. Bei der Parkinson‑Krankheit und verwandten Erkrankungen kann Alpha‑Synuclein fehlgefaltet werden und sich zu unlöslichen Aggregaten zusammenlagern, die die neuronale Kommunikation stören, synaptische Funktionen beeinträchtigen und langfristig zum Zelltod beitragen. Anstatt bestehende Aggregate aufzulösen, verfolgte ein Team unter Leitung der University of Bath die Strategie, ein Peptid zu entwerfen, das an Alpha‑Synuclein bindet und dessen gesunde Konformation stabilisiert – im Prinzip wird das Protein in einem funktionalen Zustand „eingefroren“, bevor es die pathologische Form annehmen kann. Diese präventive Herangehensweise adressiert die frühe Phase der Proteinfehlfaltung, was besonders relevant für präklinische Interventionsstrategien ist und die Möglichkeit eröffnet, neurotoxische Aggregationswege von vornherein zu blockieren.
Der Entwicklungsweg begann mit einem größeren Fragment von Alpha‑Synuclein, das zuvor bereits als in der Lage beschrieben worden war, Aggregationsprozesse zu reduzieren. Die Forschenden kürzten dieses Fragment systematisch auf die minimal notwendige, aktive Sequenz und verstärkten es chemisch durch Einbau von Lactambrücken (Cyclisierungen), also Schleifenähnlichen Verbindungen, die die Sekundärstruktur des Peptids fixieren. Solche strukturellen Verstärkungen verbessern die Konformationsstabilität und erhöhen die Resistenz gegenüber proteolytischem Abbau innerhalb der Zelle. In Wurmmodellen der Parkinson‑Pathologie verhinderte das optimierte Peptid die Fehlfaltung von Alpha‑Synuclein, reduzierte die Bildung toxischer Aggregate deutlich und zeigte dabei keine offensichtliche zelluläre Toxizität. Diese Ergebnisse deuten darauf hin, dass synthetische, stabilisierte Peptide als molekulare „Chaperone“ wirken können, die native Proteinformen bewahren und dadurch pathologische Aggregationswege unterbinden.
Warum das Verhindern von Fehlfaltung für die Krankheit wichtig ist
Es ist wichtig, zwischen Ansätzen zu unterscheiden, die bereits gebildete Aggregate entfernen, und solchen, die deren Entstehung verhindern. Aggregate können entweder eine Folge anderer krankheitsauslösender Prozesse sein oder selbst die Krankheitsprogression aktiv vorantreiben; die Trennung von Ursache und Folge stellt in der Neurodegenerationsforschung eine große methodische und konzeptuelle Herausforderung dar. Ein präventives Molekül wie das hier beschriebene Peptid zielt genau auf das früheste Ereignis in der Aggregationskaskade ab: die initiale Fehlfaltung eines normalerweise löslichen Proteins. Indem man diesen ersten Schritt blockiert, lässt sich theoretisch die gesamte nachfolgende Bildung schädlicher Oligomere und fibrillärer Strukturen verhindern, was langfristig synaptische Gesundheit und neuronale Integrität schützen könnte.
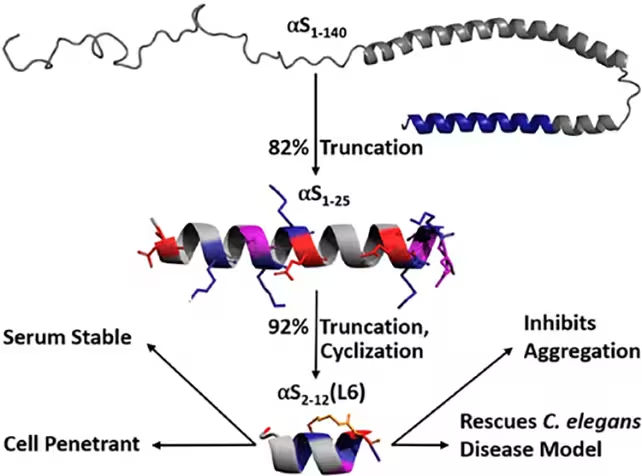
Diese präventive Perspektive könnte besonders relevant für Personen sein, die aufgrund genetischer Befunde oder Früherkennungs‑Biomarker ein erhöhtes Risiko für Parkinson haben. Zum Beispiel werden Träger bekannter Mutationen im SNCA‑Gen (das Alpha‑Synuclein kodiert) oder Personen mit frühen Biomarkern wie veränderten Liquor‑Profilen als Kandidaten für präventive Interventionen betrachtet. Wenn Alpha‑Synuclein in seinem funktionalen Zustand gehalten wird, bleibt die normale Neurotransmitter‑Regulation erhalten, während gleichzeitig die progressive Anhäufung toxischer Aggregate verhindert wird. Das Team der University of Bath betont, dass das Peptid in lebenden Systemen funktioniert und die physiologische Funktion von Alpha‑Synuclein nicht stört – ein kritisches Kriterium für jede Therapie, die ein im Gehirn reichlich vorhandenes, normalerweise nützliches Protein adressiert. Diese Balance zwischen Wirksamkeit gegen Aggregation und Schonung der normalen Proteinfunktion ist zentral für die Akzeptanz potenzieller Therapieansätze und zur Minimierung unerwünschter Nebenwirkungen.
Lieferungshürden, breitere Implikationen und zukünftige Richtungen
Trotz vielversprechender Resultate in Wurmmodellen stellen sich bei der Übersetzung eines intrazellulär stabilen Peptids in eine Humantherapie mehrere Herausforderungen. Peptide werden im Blut oft rasch eliminiert, sie haben generell Schwierigkeiten, die Blut‑Hirn‑Schranke (Blood‑Brain Barrier, BBB) zu überwinden, und können Immunantworten provozieren. Die Arbeiten aus Bath haben das Problem der intrazellulären Stabilität durch chemische Modifikationen adressiert, doch die sichere und effektive Applikation des Moleküls in menschliches Hirngewebe bleibt eine große Aufgabe der pharmazeutischen Entwicklung und des Drug‑Delivery‑Designs. Dazu gehören Formulierungsfragen, geeignete Trägersysteme, Dosisregime und Wege zur gezielten Abgabe an betroffene Hirnregionen, ohne systemische Nebenwirkungen hervorzurufen.
Von technischer Seite stehen verschiedene Strategien zur Diskussion: Nanopartikel‑Träger, konjugierte Transportpeptide, PEGylierung zur Verlängerung der Plasmahalbwertszeit oder selektive Modifikationen, die einen BBB‑Transport ermöglichen. Ebenso relevant sind immunologische Aspekte — wiederholte Verabreichungen könnten Immungedächtnis und Antikörperbildung auslösen, weshalb immunverträgliche Designs und sorgfältige Sicherheitsprüfungen im Tierversuch und später in klinischen Studien erforderlich sind. Weitere Herausforderungen sind die Skalierbarkeit der Synthese, die Stabilität in pharmakologischen Formulierungen und regulatorische Anforderungen für neuartige Wirkstoffklassen wie stabilisierte Peptide.
Das Forschungsteam und die Fördergeber betonen, dass es sich um einen frühen, wenn auch wichtigen Schritt handelt. Julia Dudley von Alzheimer's Research UK, die die Studie mitfinanziert hat, hob die weiterreichende Bedeutung hervor: Ähnliche Aggregationsprozesse liegen auch der Lewy‑Körper‑Demenz und der Alzheimer‑Krankheit zugrunde, sodass die Stabilisierung nativer Proteinkonformationen zu einer breiteren Strategie über verschiedene neurodegenerative Erkrankungen hinweg werden könnte. Die Studie ist in JACS Au (2025) veröffentlicht und baut auf früheren strukturellen Kartierungen der Interaktionsstellen von Alpha‑Synuclein auf, die als Grundlage für das rationale Design der Bindungspeptide dienten. Solche strukturbasierten Ansätze erhöhen die Wahrscheinlichkeit, hochspezifische Bindermoleküle zu entwickeln, die gezielt krankheitsassoziierte Konformationsänderungen adressieren, ohne physiologische Proteinfunktionen zu unterdrücken.
Expert Insight
„Ein Peptid zu entwerfen, das sowohl intrazellulär stabil ist als auch selektiv eine krankheitsanfällige Form eines Proteins erkennt, ist ein schwieriger Balanceakt,“ sagt Dr. Mark Ellison, ein fiktiver Neurochemiker und Wissenschaftskommunikator. „Diese Studie demonstriert einen rationellen Design‑Ansatz, der die Aggregation reduziert, ohne die normale Funktion des Proteins außer Kraft zu setzen — genau die Art von Spezifität, die wir brauchen, wenn wir von Modellorganismen auf klinische Tests hinarbeiten.“
Als nächste Schritte sieht das Team Tests in mammalen Modellen vor, die eine bessere Nachbildung der menschlichen Hirnphysiologie und der komplexen Immunantwort erlauben. Parallel sollen Lieferstrategien optimiert werden, wobei Optionen wie Nanopartikel‑Träger, liposomale Formulierungen oder modifizierte Peptide, die die Blut‑Hirn‑Schranke passieren können, untersucht werden. Langzeit‑Sicherheits‑ und Wirksamkeitsprüfungen sind essenziell, um mögliche Toxizität, Immunreaktionen oder unerwartete Wirkprofile frühzeitig zu erkennen. Gelingt die Translation bis zu klinisch relevanten Ergebnissen, könnten dieses Peptid oder verwandte Verbindungen Teil präventiver Therapieansätze für Personen mit hohem Parkinson‑Risiko oder für andere proteinaggregationsbedingte Erkrankungen werden.
Vorerst steht die Studie als Proof‑of‑Principle: Es ist möglich, kleine, rational entworfene Peptide zu entwickeln, die intrazellulär patrouillieren und schädliche Proteinaggregation blockieren, während sie die normale Biologie weitgehend unangetastet lassen. Diese Arbeit liefert eine Blaupause für krankheitsmodifizierende Ansätze in der Neurodegeneration und zeigt, wie strukturinformiertes Design in Kombination mit chemischer Modifikation und präklinischer Modellprüfung neuartige Therapieoptionen hervorbringen kann. Solche Strategien könnten mittelfristig zur Entwicklung von Präventions‑ und Frühinterventionsmaßnahmen beitragen, die das Fortschreiten neurodegenerativer Erkrankungen abmildern oder verzögern.
Quelle: sciencealert

Kommentar hinterlassen