7 Minuten
Eine neue Laborstudie der Aarhus-Universität deutet auf einen Mechanismus hin, mit dem Alpha ‑Synuclein ‑Oligomere — kleine Aggregate eines Proteins, das bereits mit der Parkinson ‑Krankheit in Verbindung gebracht wird — Zellmembranen physisch durchbrechen und vorübergehende Poren bilden können. Diese mikroskopischen Öffnungen erlauben den unkontrollierten Durchtritt von Ionen und kleinen Molekülen, stören möglicherweise die zelluläre Chemie und tragen so zur Funktionsstörung von Neuronen bei. Die Ergebnisse liefern ein detaillierteres Bild davon, wie Proteinaggregate Gehirnzellen schädigen können, und deuten auf neue Ziele für therapeutische Interventionen hin.
Wissenschaftlicher Hintergrund: Alpha ‑Synuclein, Oligomere und Neurodegeneration
Alpha ‑Synuclein ist ein normales neuronales Protein, das an der Vesikelübertragung an Synapsen und der Freisetzung von Neurotransmittern beteiligt ist. Bei der Parkinson ‑Krankheit kann es fehlfalten und sich zu größeren Fibrillen anhäufen, die als Lewy ‑Körper bezeichnet werden. Neben diesen Fibrillen werden häufig kleinere, lösliche Aggregate, sogenannte Oligomere, beobachtet — viele Forscher halten Oligomere für besonders toxisch. Die neue Studie konzentriert sich auf jene Oligomere und deren physikalische Wechselwirkung mit LipidDoppelschichten, dem grundlegenden Strukturglied von Zellmembranen.
Eine durch Oligomere verursachte Membranstörung wurde bereits vorgeschlagen, doch das Team aus Aarhus verwendete ein vereinfachtes, gut kontrolliertes Membranmodell, um den Prozess in beispielloser Detailgenauigkeit zu visualisieren. Durch die Isolierung dieser Wechselwirkung konnten sie schrittweise Veränderungen aufzeichnen, die vom Erstkontakt bis zur Porenbildung führen.
Experimenteller Aufbau und zentrale Beobachtungen
Mit synthetischen Membranmodellen, die die Lipidzusammensetzung von Neuronen nachahmen, führten die Forscher Alpha ‑Synuclein ‑Oligomere ein und überwachten die Membranintegrität mit hochauflösender Bildgebung und elektrischen Messungen. Das Team beschreibt einen dreistufigen Prozess: anfängliche Anlagerung der Oligomere an die Membranoberfläche, partielle Insertion in die LipidDoppelschicht und abschließende Umorganisation zu einer porenähnlichen Struktur, die die Membran durchspannt.
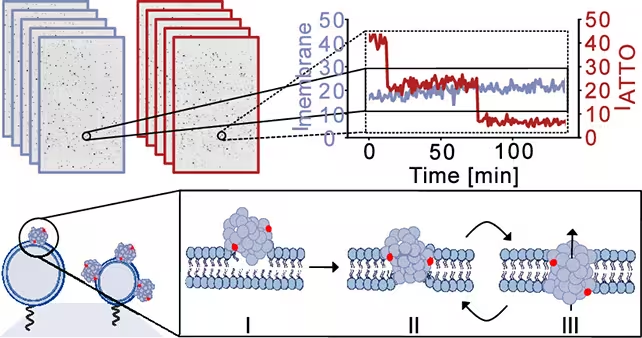
Die Forscher fertigten Momentaufnahmen der simulierten Zellmembranen an, um zu verfolgen, wie diese durchbrochen wurden und welches Leckageverhalten entstand. (Bro̷chner et al., ACS Nano, 2025)
Sobald die Poren entstanden, waren sie keine statischen Löcher. Stattdessen zeigten sie ein dynamisches Verhalten — sie öffneten und schlossen sich wiederholt in kurzen Zeitintervallen. Diese Intermittenz ist bedeutsam, weil sie episodische Ionenflüsse verursachen kann, die die zelluläre Homöostase schrittweise stören, anstatt einen sofortigen katastrophalen Ausfall zu bewirken.
Bevorzugung gekrümmter Membranen und mitochondriale Verwundbarkeit
Eine bemerkenswerte Beobachtung war die Präferenz der Oligomere für stärker gekrümmte Membranen. Stark gekrümmte Membranen sind charakteristisch für intrazelluläre Organellen wie Mitochondrien. Mitochondrien sind zentral für die Energieproduktion von Neuronen und das CalciumPuffern; werden ihre Membranen wiederholt perforiert, könnte dies zu energetischem Versagen, oxidativem Stress und nachgelagerten Wegen führen, die mit Neurodegeneration in Verbindung stehen.
Folgen für Mechanismen und Therapie der Parkinson ‑Krankheit
Falls Alpha ‑Synuclein ‑Oligomere in vivo vorübergehende Poren in neuronalen Membranen bilden, würde dies einen direkten Mechanismus liefern, wie Proteinaggregate funktionellen Abbau bewirken können, bevor Zellen absterben. Vorübergehende ionische Ungleichgewichte, die sich wiederholen, können die synaptische Signalübertragung beeinträchtigen, die Calcium ‑Homöostase stören und die neuronale Widerstandsfähigkeit allmählich schwächen. Die dynamische, reversible Natur der Poren könnte auch erklären, warum Neuronen bei der Parkinson ‑Krankheit oft über lange Zeiträume überlebensfähig bleiben, trotz fortschreitender Funktionsstörung.
Der Molekularbiologe Bo Volf Brøchner, Coautor der Studie, schlägt vor, dass das Öffnen und Schließen der Poren den zellulären Pumpen ermöglichen könnte, vorübergehend zu kompensieren und so einen raschen Zusammenbruch hinauszuzögern. Dieses Zeitfenster der Kompensation könnte eine Gelegenheit für Therapeutika darstellen, das Gleichgewicht wiederherzustellen oder die Porenbildung zu blockieren.
Das Aarhus ‑Team hat bereits molekulare Sonden, sogenannte Nanobodies — kleine Antikörperfragmente — untersucht, die oligomerisches Alpha ‑Synuclein nach seiner Assemblierung erkennen können. Während diese Nanobodies für die Detektion nützlich sind, ist es ihnen bislang nicht gelungen, die Porenbildung zu verhindern. Zukünftige therapeutische Strategien könnten darauf abzielen:
- Alpha ‑Synuclein in nicht‑toxischen Konformationen zu stabilisieren
- die Porenbildung direkt mit kleinen Molekülen oder Antikörpern zu blockieren
- mitochondriale Membranen zu schützen oder zu reparieren
- die zelluläre Clearance von Oligomeren über Proteostase‑ und Autophagie‑Wege zu verbessern
Einschränkungen und nächste Schritte
Die Experimente verwendeten saubere, synthetische Systeme, um einzelne Variablen zu isolieren. Diese experimentelle Klarheit ist eine Stärke — doch die Ergebnisse müssen nun in lebenden Neuronen und Tiermodellen validiert werden, in denen Membranzusammensetzung, Proteinpartner und zelluläre Abwehrmechanismen komplexer sind. Forscher müssen bestätigen, ob oligomergetriebene Porenbildung im intakten Gehirn auftritt, wie häufig sie vorkommt und welche Neuronentypen am anfälligsten sind.
Weitere Arbeiten sollten zudem Größe, Lebensdauer und ionische Selektivität der Poren quantifizieren und untersuchen, wie sie mit zellulären Reparaturmechanismen interagieren. Wenn dies in vivo bestätigt wird, könnten diese Poren ein messbarer Biomarker für frühen neuronalen Stress und ein Ziel für krankheitsmodifizierende Therapien werden.
Experteneinschätzung
Kommentar einer praktizierenden Neurowissenschaftlerin
Dr. Elena Marquez, Senior Lecturer in Neurobiology (fiktiv), kommentiert: „Diese Studie liefert eine überzeugende mechanistische Verbindung zwischen oligomerischem Alpha ‑Synuclein und Membrandysfunktion. Die schrittweise Visualisierung von Anlagerung, Insertion und Porenbildung hilft, biochemische Toxizität mit physiologischen Folgen in Einklang zu bringen — episodische Ionenstörungen statt sofortiger Nekrose. Aus translationaler Sicht besteht die Herausforderung nun darin, diese Ereignisse in intakten Neuronen nachzuweisen und Moleküle zu entwickeln, die entweder die Porenassemblierung verhindern oder transienten Bruchstellen schnell verschließen. Parallel dazu könnte das Anvisieren der mitochondrialen Membranintegrität besonders wertvoll sein, angesichts der Präferenz der Oligomere für gekrümmte Oberflächen."
Verwandte Technologien und zukünftige Aussichten
Mehrere komplementäre Technologien könnten die Übersetzung dieser Erkenntnisse in Therapie oder Diagnostik beschleunigen:
- Fortgeschrittene Live ‑Cell‑Bildgebung, um transient auftretende Porenereignisse in Neuronen einzufangen
- Biosensoren für Ionenflüsse und das mitochondriale Membranpotenzial
- High ‑Throughput‑Screens für kleinmolekulare Hemmer der Porenassemblierung
- Weiterentwicklung von Nanobody ‑Plattformen, um Oligomere vor ihrer Membrankontaktaufnahme zu neutralisieren
Insgesamt könnten diese Ansätze zu frühen Interventionen führen, die das Fortschreiten verlangsamen, indem wiederholte subletale Membranverletzungen verhindert werden.
Fazit
Die Studie der Aarhus ‑Universität erweitert unser Verständnis der Parkinson ‑Krankheit, indem sie zeigt, dass Alpha ‑Synuclein ‑Oligomere in Modellmembranen dynamische Poren durch eine Abfolge von Anlagerung–Insertion–Porenbildung bilden können. Diese vorübergehenden Brüche, mit einer erkennbaren Präferenz für gekrümmte Membranen wie mitochondriale Oberflächen, könnten episodische ionische Störungen erzeugen, die sich zu neuronalem Funktionsverlust aufsummieren. Zwar sind weitere Validierungen in lebenden Systemen erforderlich, doch heben die Ergebnisse neue mechanistische Ziele hervor — von der Neutralisierung von Oligomeren bis zum Membranschutz —, die künftige therapeutische und diagnostische Entwicklungen leiten könnten. Die in ACS Nano veröffentlichte Forschung eröffnet einen neuen Weg, um zu untersuchen, wie kleine Proteinaggregate zur Neurodegeneration beitragen und wie dieser Prozess vor irreversiblen Funktionsverlusten unterbrochen werden könnte.
Quelle: sciencealert

Kommentar hinterlassen