8 Minuten
Wissenschaftler der University of Wisconsin–Madison haben eine überraschende molekulare Partnerschaft identifiziert, die zum Schutz der Chromosomenenden beiträgt. Ihre Entdeckung verknüpft ein bereits gut untersuchtes DNA-bindendes Protein mit der Aktivität der Telomerase und liefert neue Hinweise darauf, warum manche Patienten an unerklärlichen, lebensbedrohlichen Erkrankungen mit verkürzten Telomeren leiden.
Warum Telomere wichtig sind und wo das Rätsel begann
Telomere sind sich wiederholende DNA‑Protein‑Kappen an den Enden der Chromosomen, die verhindern, dass das Genom ausfranst oder instabil wird. Bei jeder Zellteilung verkürzen sich Telomere geringfügig — ein normaler Bestandteil des Alterungsprozesses. Wenn Telomere zu stark schrumpfen oder nicht korrekt erhalten werden, wird DNA instabil; Zellen können aufhören sich zu teilen, vermehrt in Seneszenz gehen oder absterben. Diese Prozesse liegen einem Spektrum vorzeitiger Alterungssyndrome und mehreren schweren Bluterkrankungen zugrunde, darunter aplastische Anämie und myelodysplastische Syndrome.
Forscher verknüpfen seit langem defekte Telomerase — das Enzym, das Telomere wiederaufbaut — mit klinischen Krankheitsbildern wie aplastischer Anämie, myelodysplastischem Syndrom und akuter myeloischer Leukämie. Gleichwohl blieb in zahlreichen Fällen mit stark verkürzten Telomeren unklar, warum die Erkrankung auftrat, denn es fand sich keine erklärende Mutation in bekannten Telomerase‑Genen. Diese diagnostische Lücke und die klinische Dringlichkeit, die Ursache für idiopathische Kurz‑Telomere zu finden, bildeten den Ausgangspunkt für die hier beschriebene Studie.
Wie ein unerwarteter Partner ins Blickfeld rückte
Unter der Leitung von Prof. Ci Ji Lim nutzte das Team der UW–Madison moderne Strukturvorhersagewerkzeuge, insbesondere AlphaFold — ein auf maschinellem Lernen basierendes Tool zur Vorhersage von Proteinstrukturen und Protein‑Protein‑Interaktionen —, um mögliche Interaktionspartner der menschlichen Telomerase zu identifizieren. Die computergestützten Screening‑Analysen wiesen auf Replication Protein A (RPA) hin, ein ubiquitär vorkommendes, einzelsträngig DNA‑bindendes Protein, das bislang vor allem für seine zentralen Rollen bei DNA‑Replikation und DNA‑Reparatur bekannt ist. Die Daten lieferten den ersten Hinweis, dass RPA plausiblerweise auch als Ko‑Faktor der Telomerase fungieren könnte.
Vom Modell zum Molekül: experimentelle Validierung
Anhand der AlphaFold‑Vorhersagen führten Doktorand Sourav Agrawal, Forschungswissenschaftlerin Xiuhua Lin und Postdoktorand Vivek Susvirkar biochemische Experimente durch, die die computergestützten Hypothesen bestätigten. In humanen Zellmodellen erwies sich RPA als erforderlich, um die Telomeraseaktivität zu stimulieren und die Telomerlänge zu erhalten. Anders formuliert: RPA bindet nicht nur einzelsträngige DNA während Replikation und Reparatur, sondern unterstützt die Telomerase auch aktiv bei ihrer Aufgabe an den Chromosomenenden. Die Kombination aus in silico‑Vorhersage und klassischen biochemischen Assays ermöglichte eine robuste Validierung der funktionellen Rolle von RPA.
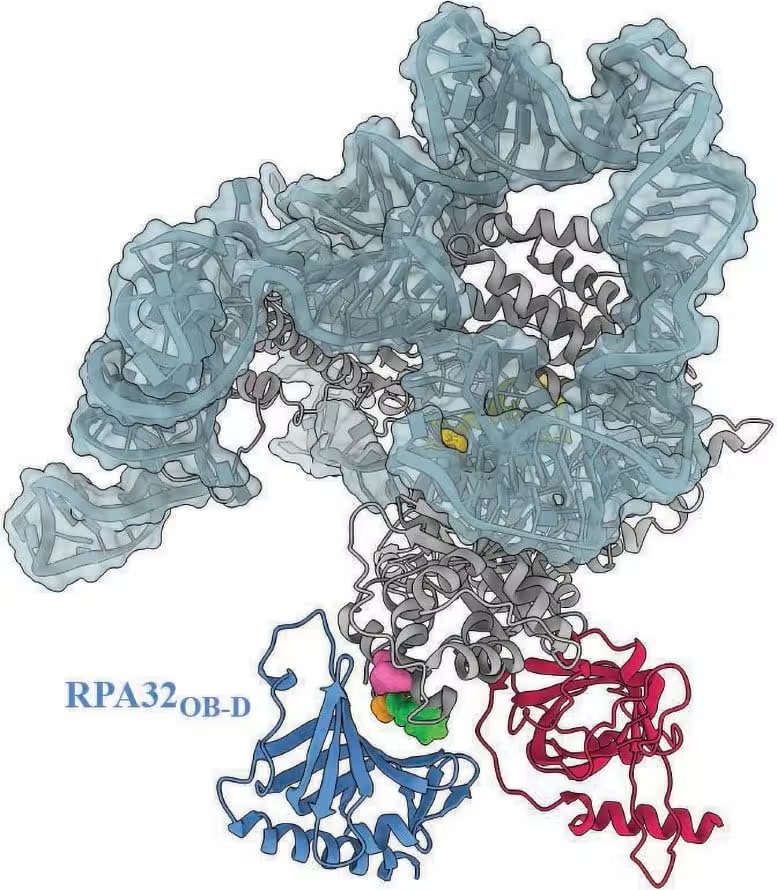
Ein Modell des menschlichen Telomerasekomplexes hebt die Stelle hervor, an der RPA voraussichtlich andockt. Drei strukturelle Varianten der Telomerase, die mit verschiedenen Erkrankungen in Verbindung gebracht wurden, liegen innerhalb dieser Andockzone, was nahelegt, dass diese Varianten die Interaktion zwischen RPA und Telomerase blockieren könnten. Credit: Ci Ji Lim
Klinische Bedeutung: eine fehlende Erklärung für kurz‑Telomer‑Erkrankungen
Lim betonte die klinische Relevanz der Ergebnisse: ‚Diese Forschungsrichtung geht über das rein biochemische Verständnis eines molekularen Prozesses hinaus und vertieft das klinische Verständnis von Telomererkrankungen.‘ Das Team zeigte, dass einige krankheitsassoziierte Telomerase‑Varianten innerhalb der vorhergesagten RPA‑Andockzone liegen. Diese räumliche Überlappung legt nahe, dass solche Varianten RPA daran hindern können, die Telomerase zu stimulieren — eine plausible Erklärung für den unerklärten kurzen‑Telomer‑Phänotyp, den Kliniker bei bestimmten Patienten beobachten.
Die Entdeckung liefert Ärzten und Genetikern einen neuen Ansatzpunkt bei der Diagnostik von Patienten mit unerklärter Telomerverkürzung. Statt ausschließlich nach Mutationen in Telomerase‑Kernen zu suchen, können Kliniker nun auch prüfen, ob Variationen vorliegen, die die RPA–Telomerase‑Interaktion stören. Solche Tests könnten Ursachen aufdecken, die zuvor als mysteriös galten, und damit die genetische Diagnostik und Beratung verbessern.
Weltweites Interesse und die nächsten Schritte für Tests
Die Arbeit hat bereits international Aufmerksamkeit erregt. Lim berichtet von Anfragen aus Kliniken und von Forschern in Ländern wie Frankreich, Israel und Australien, die Interesse an biochemischen Tests zeigen, um zu bewerten, ob die Mutationen ihrer Patienten die RPA‑Bindung oder die Stimulation der Telomerase beeinträchtigen. Solche Nachuntersuchungen sind für die Translation in die klinische Praxis wichtig, da Diagnosen so schneller und gezielter gestellt werden können.
‚Es gibt Patienten mit Verkürzungen der Telomere, deren Zustand sich mit unserem bisherigen Wissen nicht erklären ließ,‘ sagte Lim. ‚Nun haben wir für einen Teil dieser Mutationen eine zugrundeliegende Ursache: RPA kann die Telomerase nicht effektiv stimulieren.‘ Mit standardisierbaren biochemischen Assays kann das Team Patientenvarianten funktionell bewerten und Ärzten Hinweise zu möglichen Krankheitsmechanismen, Prognosen und potenziellen therapeutischen Ansätzen liefern.
Werkzeuge und Technologien, die das ermöglichten
Die Studie veranschaulicht, wie moderne Strukturvorhersagewerkzeuge wie AlphaFold experimentelle Arbeiten im Nasslabor effektiv lenken können. Durch eine priorisierte Liste von Kandidateninteraktionen reduziert die in silico‑Vorarbeit die Zahl erforderlicher Experimente und fokussiert die Ressourcen auf die vielversprechendsten Hypothesen. Anschließend bestätigten klassische biochemische Assays die Rolle von RPA. Dieser kombinierte Ansatz beschleunigt den Weg von der Hypothese zur klinisch relevanten Erkenntnis und zeigt die Bedeutung interdisziplinärer Zusammenarbeit zwischen Biochemie, struktureller Bioinformatik und molekularer Medizin.
Technische Details und methodische Einordnung
AlphaFold‑Modelle lieferten Vorhersagen sowohl zur dreidimensionalen Faltung von Einzelproteinen als auch zur möglichen Oberfläche für Protein‑Protein‑Interaktionen. Die Forscher nutzten diese strukturellen Hinweise, um spezifische Aminosäurereste als potenzielle Andockstellen zu identifizieren und anschließend Mutationsanalysen sowie Ko‑Immunpräzipitationen, Oberflächenplasmonresonanz (SPR) oder ähnliche Bindungsassays durchzuführen. Ergänzend dazu kamen Zellkulturexperimente zum Einsatz, in denen RPA‑Expression moduliert wurde, um direkte Effekte auf Telomeraseaktivität (gemessen etwa mittels TRAP‑Assay) und Telomerlänge zu verfolgen. Die Kombination aus struktureller Vorhersage, gezielten Mutationsanalysen und funktionellen Assays erhöhte die Aussagekraft der Befunde.
Implikationen für genetische Diagnostik und Beratung
Die Erkenntnis, dass Störungen der RPA–Telomerase‑Interaktion eine Ursache für idiopathische Telomerkürzung sein können, erweitert das diagnostische Spektrum. In der Praxis könnte dies bedeuten, dass Sequenzierungs‑Panels für Telomeropathien neben klassischen Telomerasegenen (wie TERT, TERC, DKC1) auch Regionen umfassen, die für die RPA‑Bindung relevant sind, beziehungsweise dass funktionelle Assays implementiert werden, um Varianten auf ihre Auswirkung auf die Protein‑Protein‑Interaktion zu testen. Ein solcher multimodaler Ansatz — Genotypanalyse ergänzt durch funktionelle Validierung — erhöht die diagnostische Treffergenauigkeit und unterstützt eine bessere genetische Beratung betroffener Familien.
Therapeutische Perspektiven
Aus therapeutischer Sicht eröffnet die neue Einsicht verschiedene Möglichkeiten: Wenn bestimmte Patientenvarianten die RPA‑Stimulation der Telomerase verhindern, könnten Strategien zur Wiederherstellung oder Nachahmung dieser Stimulation denkbar sein. Das reicht von kleinen Molekülen oder Peptid‑Mimetika, die die Interaktion stabilisieren, bis hin zu gentherapeutischen Ansätzen, die die defekte Andockstelle korrigieren oder alternative Wege zur Telomeraseaktivierung schaffen. Solche Ansätze erfordern jedoch umfangreiche präklinische Studien, um Spezifität, Wirksamkeit und Sicherheit zu prüfen — insbesondere weil eine unkontrollierte Telomeraseaktivierung mit einem erhöhten Krebsrisiko verbunden sein kann. Die Herausforderung besteht darin, therapeutische Eingriffe so zu gestalten, dass sie gewebespezifisch, zeitlich kontrolliert und sicher sind.
Expertinnen‑ und Experteneinschätzung
Dr. Elena Morales, Molekulargenetikerin, die nicht an der Studie beteiligt war, merkte an: ‚Die Verknüpfung von RPA mit der Telomerase öffnet eine neue Regulationsebene für den Telomer‑Erhalt. Klinisch hilft dies, eine Untergruppe von Patienten mit idiopathischer Telomerverkürzung zu erklären. Therapeutisch wäre es interessant, Wege zu finden, die stimulierende Wirkung von RPA auf die Telomerase wiederherzustellen oder zu imitieren.‘
Weitere externe Expertinnen und Experten weisen darauf hin, dass die Kombination aus strukturbiologischer Vorhersage und funktioneller Validierung ein Modell für künftige Entdeckungen darstellt: Ähnliche Strategien könnten genutzt werden, um andere unerklärte genetische Phänotypen zu untersuchen, bei denen die direkte Suche nach Mutationen in bekannten Enzymgenen nicht zielführend war.
Ausblick: Von der Forschung in die Klinik
Wenn Forscher die erwähnten biochemischen Tests standardisieren und größeren Patientenkohorten anbieten, könnten Diagnosen für Familien mit Kurz‑Telomer‑Syndromen schneller fallen. Routinetests auf RPA‑interferierende Varianten würden die Einrichtung diagnostischer Algorithmen verändern und könnten die Grundlage für molekular begründete Therapiestrategien bilden. Zudem könnten longitudinal angelegte Studien zu Patientengruppen mit solchen Varianten Aufschluss über Krankheitsverlauf, Komorbiditäten und Ansprechen auf eventuell künftige Therapien geben.
Langfristig kann diese Forschung dazu beitragen, die Wissenslücke bei sogenannten Telomeropathien zu schließen: Sie liefert sowohl diagnostische Marker als auch Ansatzpunkte für therapeutische Interventionen und verbessert damit die Präzisionmedizin in diesem Bereich der Hämatologie und Altersforschung.
Quelle: scitechdaily

Kommentar hinterlassen