8 Minuten
Spezifisch entwickelte, "jung wirkende" Immunzellen, die aus menschlichen induzierten pluripotenten Stammzellen (iPS-Zellen) erzeugt wurden, scheinen bei gealterten Mäusen einen Teil der kognitiven Funktion und die Gesundheit von Gehirnzellen wiederherzustellen, so eine neue Studie des Cedars-Sinai Medical Center. Die Arbeit deutet auf einen zellbasierten Ansatz hin, um altersbedingtem Abbau und bestimmten Merkmalen der Alzheimer-Krankheit entgegenzuwirken, auch wenn bedeutende Einschränkungen und offene Fragen bestehen.
Warum „Reinigungskräfte“ des Immunsystems für ältere Gehirne wichtig sind
Monozytär-phagozytische Zellen (Mononukleäre Phagozyten) sind mobile Immunzellen, die den Körper durchstreifen, Abbauprodukte und tote Zellen entfernen und so zur Gewebehomöostase beitragen. Im zentralen Nervensystem ist die spezialisierte Form dieser Zellen als Mikroglia bekannt: Mikroglia reguliert Entzündungsreaktionen, entfernt aggregierte Proteine und trägt zur Synapsenmodulation bei. Mit zunehmendem Alter nimmt jedoch die Effizienz dieser „Aufräumtruppe“ ab; sie werden dysfunktional, zeigen veränderte Genexpressionsprofile und neigen dazu, proinflammatorische Signale zu verstärken. Diese Veränderung der Immunhomöostase wird mit kognitivem Abbau und neurodegenerativen Krankheiten wie Alzheimer in Verbindung gebracht.
Aus Sicht der Neuroimmunologie sind zwei Aspekte besonders relevant: Erstens fördert eine chronisch erhöhte Entzündungsbereitschaft (neuroinflammation) neuronale Fehlfunktionen und synaptischen Verlust. Zweitens kann eine reduzierte Fähigkeit zur Clearance von Proteinklumpen — etwa Amyloid-beta — zu ihrer Akkumulation beitragen, was pathologische Prozesse weiter antreibt. Daher sind Immunzellen, die beschädigtes Gewebe und toxische Aggregate effizienter entfernen, potenziell schützend für die Hirnstruktur und die kognitive Leistung.
Wie die Forscher ein „jünger wirkendes“ Immunsystem erzeugten
Anstatt junges Blut zu transfundieren, züchtete das Team um Wissenschaftler von Cedars-Sinai im Labor Chargen mononukleärer Phagozyten aus humanen induzierten pluripotenten Stammzellen (iPSCs). iPS-Zellen entstehen, indem adulte somatische Zellen reprogrammiert werden und anschließend wieder in unterschiedliche Zelltypen differenziert werden können. Dadurch bieten sie eine erneuerbare, potenziell patientenspezifische Quelle für therapeutische Zellen und sind ein zentrales Werkzeug in der regenerativen Medizin und Zelltherapie.
Die Forscher differenzierten iPS-Zellen gezielt zu einem mononukleär-phagozytischen Zelltyp, den sie in ihrer Studie als „Aging iMP" bezeichneten (iMP = induzierte mononukleäre Phagozyten). Diese Labor-„Immunreiniger" wurden dann systemisch in ältere Mäuse und in Mausmodelle mit Alzheimer-ähnlicher Pathologie injiziert, um zu prüfen, ob die Zellen kognitive Funktionen und die Gesundheit neuronaler Populationen beeinflussen können.
Technisch umfasst die Herstellung solcher Zellen mehrere Schritte: Zellkultur unter kontrollierten Bedingungen, gerichtete Differenzierung durch Wachstumsfaktoren und Signalmoleküle, Qualitätskontrollen (z. B. Phänotypisierung per Immunmarker) und Standardisierung der Herstellungsprozesse, um klinische Anforderungen an Reinheit, Identität und Sicherheit zu erfüllen. Die Verwendung von iPS-Zellen bietet Vorteilspunkte wie die Möglichkeit zur Autologenzucht (patienteneigene Zellen) und zur Skalierung, stellt aber zugleich Anforderungen an die regulatorische Validierung und an die Minimierung von Risiken wie unbeabsichtigter Differenzierung oder immunologischer Reaktivität.
Illustration von Amyloid-Plaques (orange) und Mikroglia-Zellen (rot) zwischen Neuronen
Ermutigende Verbesserungen — aber kein Allheilmittel
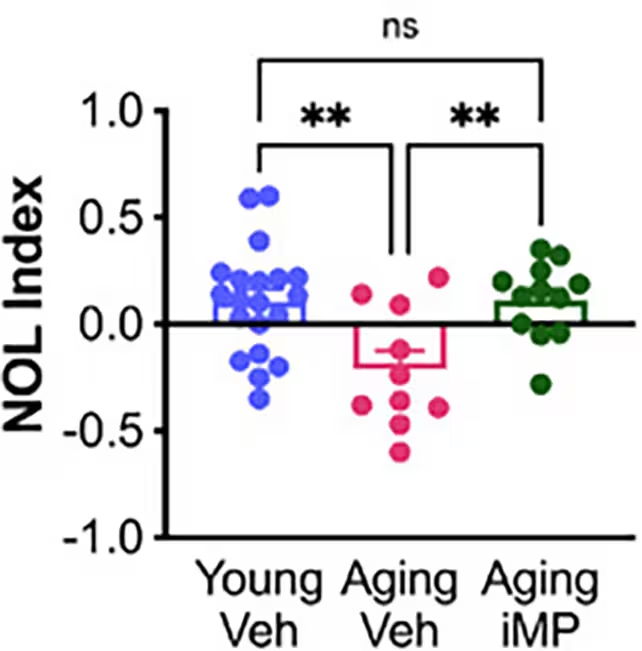
In Verhaltensaufgaben, etwa dem Test zur Neu-Ort-Lokalisierung (Novel Object Location), erreichten ältere Mäuse, die die im Labor gezüchteten Immunzellen erhielten (in der Studie als „Aging iMP" bezeichnet), Leistungen, die mit den Werten jüngerer Kontrolltiere vergleichbar waren. Solche Verhaltensdaten sind zentrale Indikatoren für Gedächtnisleistung und räumliche Orientierung und deuten auf eine funktionelle Erholung bestimmter kognitiver Komponenten hin.
Neben Verhaltensbefunden beobachteten die Autoren Veränderungen auf zellulärer Ebene: Die behandelten Tiere zeigten Merkmale „gesünderer" Mikroglia — zum Beispiel morphologische und molekulare Marker, die eine weniger proinflammatorische Aktivität andeuten — sowie eine erhaltene Population von Mooszellen (mossy cells). Mooszellen sind eine spezifische Gruppe von Neuronen im Hippocampus, die synaptische Netzwerke unterstützen, an Gedächtnisprozessen beteiligt sind und typischerweise mit Alterung und in Alzheimer-Modellen abnehmen.
Erstautorin Alexandra Moser und Kolleginnen berichten, dass die Zahl der Mooszellen in den behandelten Mäusen nicht abnahm, was eine plausible Verbindung zu den beobachteten Gedächtnisgewinnen nahelegt. Coautor Clive Svendsen stellte die Strategie als pragmatische Alternative zur direkten Verabreichung von jungem Plasma dar: Anstatt komplettes Plasma zu transfundieren, könnten im Labor hergestellte Immunzellen verjüngende Faktoren liefern, dabei standardisiert und nach klinischen Herstellungsstandards produziert werden.
Was erreichte tatsächlich das Gehirn?
Bemerkenswert ist, dass die injizierten Immunzellen offenbar nicht direkt in das Gehirn der Tiere einwanderten. Das spricht für einen indirekten Wirkmechanismus: Die im Kreislauf zirkulierenden, „jungen" mononukleären Phagozyten könnten nützliche Proteine, Zytokine oder extrazelluläre Vesikel (kleine membranumhüllte Partikel, die Signale zwischen Zellen transportieren) sezernieren, welche die Blut-Hirn-Schranke passieren oder über periphere Signalkaskaden residenten Mikroglia positive Impulse geben. Solche systemisch-zu-Gehirn-Signalmechanismen sind ein aktives Forschungsfeld in der Neuroimmunologie und könnten erklären, wie periphere Zelltherapien zentrale Effekte vermitteln.
Mechanistisch lassen sich mehrere Szenarien unterscheiden: a) Direkte Übertragung von extrazellulären Vesikeln (EVs), die mRNA, miRNA, Proteine oder Lipide enthalten und neuronale Prozesse modulieren; b) Sekretion löslicher Faktoren, die neuroinflammatorische Pfade dämpfen; c) Modulation des peripheren Immunsystems, wodurch sekundäre Effekte auf die Mikroglia-Physiologie entstehen. Weitere Arbeiten sind nötig, um die relevanten Moleküle, Signalwege und Zeitfenster zu identifizieren.
Begrenzungen und Vorbehalte
Die erzielten Vorteile waren in natürlich gealterten Mäusen am deutlichsten; in den Alzheimer-Modelltieren fielen die Effekte moderater aus. Deutliche, krankheitsspezifische Schäden — einschließlich der Akkumulation von Amyloid-beta — wurden nicht vollständig rückgängig gemacht. Das bedeutet: Die Behandlung beeinflusst Aspekte der Immunregulation und Zellgesundheit, ist aber keine vollständige Reparatur bereits etablierter neuropathologischer Ablagerungen.
Zudem ist zu betonen, dass Ergebnisse aus Nagetierexperimenten nicht zwangsläufig auf den Menschen übertragbar sind. Translationaler Erfolg erfordert robuste Sicherheitsdaten, die Bestimmung optimaler Dosierungen, Verabreichungswege (z. B. intravenös vs. intranasal) und langlebige Wirksamkeit in größeren, klinisch relevanteren Modellen. Potentielle Risiken umfassen immunologische Reaktionen, unerwünschte Systemeffekte und die Kontrolle von Proliferation oder Fehlprogrammierung transplizierter Zellen.
Potentieller Therapiepfad und zukünftige Richtungen
Wenn iPSC-abgeleitete mononukleäre Phagozyten aus den eigenen Zellen eines Patienten hergestellt werden können, könnten manche Komplikationen von Plasmatransfusionen oder Knochenmarktransplantationen umgangen werden, etwa immunologische Inkompatibilitäten oder transfusionsbedingte Nebenwirkungen. Ein autologer Ansatz würde das Risiko von Abstoßungsreaktionen senken, erhöht jedoch Aufwand und Kosten der Herstellung. Alternativ könnten bankfähige allogene Zelllinien mit reduziertem Immunprofil entwickelt werden, um eine breitere Verfügbarkeit zu ermöglichen.
Die Autoren schlagen vor, dass eine kurzfristige systemische Behandlung ausreichen könnte, um die Immunsignale neu zu justieren und die Kognition zu verbessern. Das eröffnet mehrere therapeutische Wege: direkte Zelltherapien, isolierte extrazelluläre Vesikel als zellfreie Therapie, oder die Identifikation der verantwortlichen Moleküle, die als Ziele für Medikamente oder Biologika dienen könnten. Letzteres würde potenziell die Notwendigkeit einer Zelltransplantation umgehen und die Entwicklung standardisierter Pharmaka ermöglichen.
Wesentliche nächste Schritte sind: detaillierte Proteom- und Transkriptomanalysen der sezernierten Faktoren, funktionelle Tests isolierter Vesikel in vivo, Langzeit-Sicherheitsstudien, und schließlich stufenweise präklinische Studien, die auf die Anforderungen regulatorischer Behörden abzielen. Parallel sollten Herstellungsprozesse (GMP-Standards), Stabilitätstests und Qualitätskontrollen etabliert werden, um eine klinische Entwicklung realistisch zu machen.
Experteneinschätzung
„Diese Studie rückt das Immunsystem als Stellhebel für Gehirnverjüngung in den Fokus“, sagt die fiktive Neuroimmunologin Dr. Lena Ortiz vom Institute for Brain Health. „Selbst ohne dass die Zellen direkt ins Gehirn einwandern, können periphere Immunzellen molekulare Signale aussenden, die Entzündungen umformen und neuronale Netzwerke unterstützen. Die Herausforderung besteht nun darin, diese molekularen Signale in eine reproduzierbare, sichere Behandlung für Menschen zu übersetzen.“
Solche Expertenkommentare unterstreichen die Relevanz von interdisziplinärer Forschung zwischen Neurobiologie, Immunologie und Zelltherapie-Entwicklung. Sie betonen auch die Notwendigkeit sorgfältiger Validierung, bevor klinische Studien am Menschen begonnen werden.
Einordnung der Forschung in das größere Forschungsfeld
Die Ergebnisse fügen sich in eine wachsende Evidenzlage ein, laut der systemische Faktoren — blutgebundene Proteine, Immunzellen und extrazelluläre Vesikel — das Altern des Gehirns beeinflussen können. Frühere Experimente zeigten kognitive Verbesserungen, wenn ältere Tiere junges Blut oder junges Knochenmark erhielten; die aktuelle Studie isoliert mononukleäre Phagozyten als plausiblen Mediator dieses Effekts und bietet zugleich einen herstellbaren Weg, den Nutzen zu reproduzieren.
Konkrete nächste Schritte umfassen das Mapping der aktiven Moleküle, Tests von extrazellulären Vesikeln als zellfreie Therapeutika und präklinische Sicherheitsstudien. Wenn die molekularen Mediatoren identifiziert werden können, bieten sie Ansatzpunkte für Medikamente oder biologische Wirkstoffe, die das verjüngende Signal nachahmen, ohne auf Zelltransplantation angewiesen zu sein.
Obwohl dieser Forschungsansatz weit entfernt von einer klinisch praktischen Lösung gegen Alzheimer ist, signalisiert die Arbeit eine strategische Verschiebung: Anstatt ausschließlich zu versuchen, jede Amyloid-Plakette zu entfernen, könnte die Unterstützung des Immunmilieus im Gehirn und der neuronalen Unterstützungszellen dazu beitragen, Funktion zu bewahren und den kognitiven Abbau zu verzögern. Solche Ansätze könnten komplementär zu bestehenden Therapien wirken und neue Kombinationstherapien ermöglichen, die Immunmodulation, Proteinclearance und neuronalen Schutz verbinden.
Quelle: sciencealert


Kommentar hinterlassen