8 Minuten
Wissenschaftler am Cincinnati Children’s Hospital Medical Center haben in Zusammenarbeit mit Roche eine miniaturisierte menschliche Leberplattform entwickelt, die immunvermittelte Arzneimittelreaktionen nachbilden kann, die nur bei bestimmten Patientengruppen auftreten. Durch die Kombination patientenabgeleiteter Stammzellen mit den jeweils eigenen Immunzellen rekonstruierten die Forschenden im Labor eine seltene, aber ernsthafte Form der arzneimittelinduzierten Leberschädigung — ein Fortschritt, der die Sicherheitsprüfungen von Medikamenten nachhaltig verändern könnte.
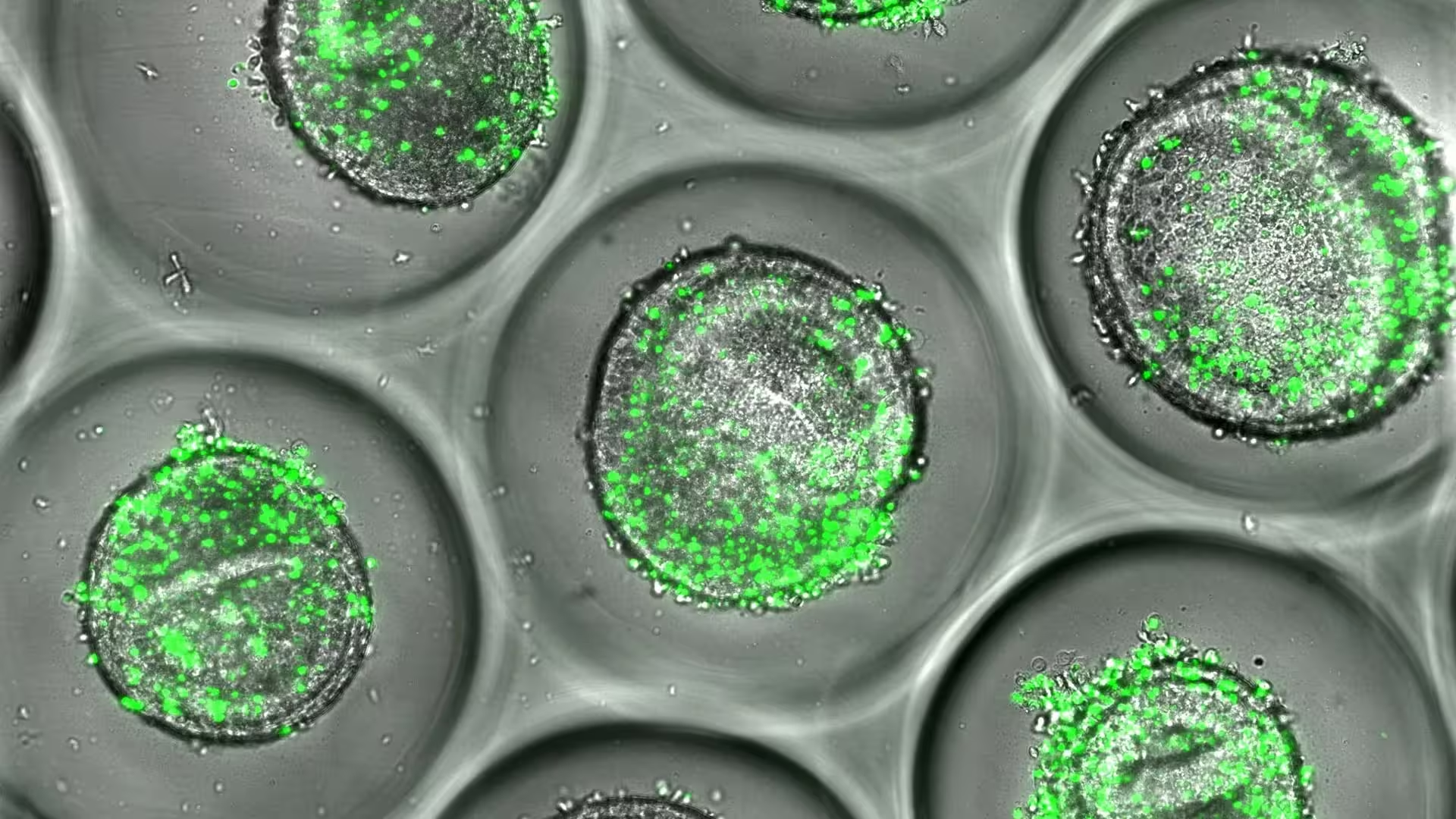
Beispiel menschlicher Leberorganoide, die zusammen mit autologen CD8-T-Zellen (grün) kultiviert wurden. Laut neuer Forschungsergebnisse von Experten am Cincinnati Children's können diese Gewebemodelle in der Arzneimittelentwicklung eingesetzt werden, um Lebertoxizität vorherzusagen.
Ein im Labor gezüchteter Leberansatz, der genetische Informationen bewahrt
Arzneimittelinduzierte Leberschädigung (drug-induced liver injury, DILI) ist eine der Hauptursachen für akutes Leberversagen und ein häufiger Grund für den Rückruf von Medikamenten vom Markt. Insbesondere die seltenen, immunvermittelten Formen — als idiosynkratische DILI (iDILI) bezeichnet — entziehen sich meist der Vorhersage durch Standard-Präklinika, weil sie von individuellen genetischen Faktoren und spezifischen Immunreaktionen abhängen. Die neue Plattform schließt diese Lücke, indem sie ein immunkompetentes, vollständig humanes Lebermodell bereitstellt, das die genetische Signatur des jeweiligen Patienten integriert.
Technisch basiert das System auf induzierten pluripotenten Stammzellen (iPSCs), die aus Spenderzellen gewonnen werden, um dreidimensionale Leberorganoide heranwachsen zu lassen. Diese miniaturisierten Gewebseinheiten werden anschließend mit den CD8+ T-Zellen desselben Spenders zusammengebracht — jene Immunzellen, die fehlgeleitet Leberzellen angreifen können, wenn sie Arzneimittel-assoziierte molekulare Muster erkennen. Das resultierende Mikroarray erhält sowohl genetische als auch immunologische Individualität und erlaubt Forschenden, in Echtzeit zu beobachten, wie bestimmte Kombinationen Entzündungsprozesse, Zytokinfreisetzung und Zelltod auslösen.
Indem das Modell sowohl zelluläre Hepatozyten-Funktionen als auch adaptive Immunantworten integriert, bietet es eine präzisere Plattform zur Untersuchung von Mechanismen wie Haptenbildung, Peptid-Präsentation durch HLA-Moleküle und T‑Zell-Reaktivierung. Solche Details sind entscheidend, um die Pathogenese der iDILI auf molekularer Ebene aufzuschlüsseln und potenzielle Biomarker für Empfindlichkeit gegenüber bestimmten Substanzen zu identifizieren. Zusätzlich ermöglichen die iPSC-basierten Leberorganoide die wiederholte, standardisierte Erzeugung von Gewebe ohne den Bedarf an frisch gewonnenem Primärmaterial.
Wie das Organoid-Microarray reale Arzneimittelwirkung nachbildet
Als Konzeptnachweis wählten die Autoren das Antibiotikum Flucloxacillin, das dafür bekannt ist, Leberschäden nahezu ausschließlich bei Trägern der HLA-B*57:01-Variante auszulösen. Konventionelle Tiermodelle und vereinzelte Zellkulturen zeigen diesen selektiven Effekt selten, doch das Organoid-Kokultur-System reproduzierte die charakteristischen Merkmale einer immunvermittelten Leberschädigung: Aktivierung von CD8+ T‑Zellen, verstärkte inflammatorische Signalgebung und nachweisbare Hepatozytenschädigung. Diese enge Übereinstimmung mit klinischen Beobachtungen unterstreicht das Potenzial des Ansatzes für die prädiktive Toxikologie.
Die Autorinnen Fadoua El Abdellaoui Soussi, PhD, und Magdalena Kasendra, PhD, heben hervor, dass die Integration patientenspezifischer Immunzellen das fehlende Puzzleteil war, um idiosynkratische Reaktionen nachzubilden. Kasendra, Direktorin für Forschung und Entwicklung am Center for Stem Cell and Organoid Medicine (CuSTOM) von Cincinnati Children’s, betont, dass es darum gehe, menschliche Biologie in einem skalierbaren, reproduzierbaren Format abzubilden, das die Arzneimittelentwicklung früher und zuverlässiger informieren kann.
Methodisch erlaubt die Plattform die simultane Messung mehrerer Endpunkte: Immunzellaktivierung (z. B. CD107a, Granzyme B), Zytokin- und Chemokinprofile (IFN-γ, TNF-α, IL‑6), metabolische Veränderungen in Hepatozyten sowie strukturelle Markierungen von Zellschaden (LDH-Freisetzung, Apoptosemarker). Diese multiparametrische Auslesung erhöht die Sensitivität und Spezifität gegenüber einfachen Ein-Parameter-Tests und unterstützt die Identifikation devianten Signaturmusters, die klinisch relevant sind.
Vom Laborverfahren zur klinischen Anwendung: technische Durchbrüche
Die Plattform baut auf früheren Organoid-Innovationen auf, indem sie eine matrixfreie Microarray-Technologie mit methodischen Verfeinerungen aus Laboren kombiniert, die robuste Leberorganoide aus iPSCs erzeugen. Dieser technische Mix ermöglicht eine höhere Durchsatzfähigkeit als klassische Organoidkulturen, während die wichtigen Merkmale einer menschlichen Immunantwort erhalten bleiben. Für die Beschleunigung der Entwicklung und Validierung war die Kooperation mit Roche entscheidend: Das Pharmaunternehmen stellte translational-toxikologische Expertise sowie zusätzliche Ressourcen zur Verfügung.
Wesentliche Elemente des technischen Fortschritts sind automatisierte Pipettier- und Kulturplattformen, standardisierte Qualitätskontrollen für iPSC-Differenzierung, und Bildgebungs- sowie Analyse-Pipelines für die quantitative Auswertung von Immunreaktionen und Zellschäden. Die matrixfreie Microarray-Anordnung reduziert Variabilität, erleichtert die Aufnahme in High-Content-Imaging-Systeme und ist kompatibel mit robotergestützter Verarbeitung, was die Skalierbarkeit für Screenings erhöht.
Die Forschenden gehen über die Reproduktion einer einzigen Gen-Drug-Interaktion hinaus: Sie automatisieren Assays und erweitern den Donorenpool, um eine breite genetische Diversität abzudecken. Das Ziel ist ein Screening-System, das potenzielle immunvermittelte Toxizitäten über Populationen hinweg vor der klinischen Testphase identifizieren kann. Eine derartige Kapazität würde das Patientenrisiko reduzieren und späte Studienabbrüche vermeiden helfen.
Neben der reinen Toxizitätsprognose eröffnet die Plattform Möglichkeiten zur Wirkstoffoptimierung: Durch frühzeitige Identifikation immunogener Substrukturen können Chemiker Molekülmodifikationen vornehmen, um die Immunogenität zu senken, ohne die Wirksamkeit zu beeinträchtigen. Darüber hinaus lassen sich companion diagnostics entwickeln, die Patienten mit erhöhtem genetischen Risiko identifizieren — ein Schritt in Richtung personalisierter Arzneimittelsicherheit.
Auswirkungen für Patientinnen, Patienten und Arzneimittelhersteller
Für Patientinnen und Patienten deutet die Plattform auf eine Zukunft, in der Sicherheitstests individuelle genetische Risiken berücksichtigen. Man kann sich vorstellen, dass ein Wirkstoffkandidat gegen ein Panel von Organoid‑Immun-Kopplungen getestet wird, das tausende genetische Profile repräsentiert. Auf diese Weise könnten Entwickler vulnerablen Subgruppen frühzeitig identifizieren und Studien sowie begleitende Diagnostika so gestalten, dass gefährdete Personen geschützt werden.
Für die Industrie bedeuten skalierbare humane Modelle, die immunvermittelte Toxizität aufdecken, potenziell geringere Attrition, schnellere Entscheidungsprozesse und letztlich niedrigere Kosten durch vermiedene späte Studienabbrüche. Zugleich stärkt diese Arbeit die Felder regenerative Medizin und präzisionsbasierte Toxikologie, indem sie Stammzellforschung mit angewandter Sicherheitsprüfung verbindet — eine Integration, die bereits von Partnern aus Biotech und Instrumentenherstellung, darunter Molecular Devices und Danaher, unterstützt wird.
Darüber hinaus kann ein validiertes humanes Screening-Portfolio die Abhängigkeit von Tiermodellen reduzieren, ethische Fragestellungen adressieren und die Relevanz präklinischer Daten für den Menschen erhöhen. Solche Modelle könnten künftig regulatorische Prüfpfade ergänzen und als ergänzende Evidenzquelle für Zulassungsbehörden dienen, insbesondere wenn sie durch interlaborative Validierung und robuste Leistungsmessungen gestützt werden.
Experteneinschätzung
„Dies stellt einen Wendepunkt auf dem Weg zu wirklich prädiktiver Toxikologie dar“, sagt Dr. Elena Mora, klinische Pharmakologin an der University of Oxford (Zitatanmerkung: Kommentar zum Kontext). „Indem das Modell beschreibt, wie das Immunsystem eines Patienten mit seinem eigenen Lebergewebe interagiert, können Forschende Muster aufdecken, die Tierversuche oder isolierte Zellkulturen übersehen. Es wird klinische Studien nicht ersetzen, aber sie intelligenter und sicherer machen.“
Solche fachlichen Einschätzungen unterstreichen den Mehrwert, den patientenspezifische Modelle in der Risikobewertung bieten. Expertinnen und Experten weisen zugleich auf die Notwendigkeit hin, standardisierte Validierungsprotokolle zu etablieren, um die Übertragbarkeit der Ergebnisse über verschiedene Laborplattformen hinweg zu gewährleisten.
Herausforderungen und der Weg nach vorn
Trotz des vielversprechenden Ansatzes bleiben wesentliche Herausforderungen. Die Skalierung der Organoidproduktion bei gleichbleibender biologischer Treue ist technisch anspruchsvoll, und die Sicherstellung reproduzierbarer Assays über verschiedene Labore hinweg erfordert Standardisierung und Qualitätsmanagement. Immunvermittelte Reaktionen sind zudem multifaktoriell: Umweltfaktoren, Begleitmedikationen und chronische Erkrankungen können das Risiko zusätzlich modulieren — über reine Genetik und CD8+ T‑Zell‑Verhalten hinaus.
Das Team räumt diese Einschränkungen offen ein und verfolgt Strategien wie Automatisierung, erweiterte Donorenrekrutierung (inklusive ethnischer Diversität) und die Integration zusätzlicher Immunzelltypen (etwa CD4+ T‑Zellen, NK‑Zellen und antigenpräsentierende Zellen), um die Komplexität besser abzubilden. Parallel arbeiten die Forschenden an robusten Validierungsstudien, die klinische Daten mit In-vitro-Resultaten korrelieren, um prädiktive Kennzahlen zu etablieren.
Die 2025 in Advanced Science veröffentlichte Studie vom 26. September positioniert Cincinnati Children’s CuSTOM Accelerator als Vorreiter bei der Übersetzung von Organoid-Forschung in praktische Werkzeuge. Nach Ansicht der Autorinnen ist dies ein früher, aber bedeutsamer Schritt in Richtung personalisierter Arzneimittelsicherheitsbewertungen — eine Entwicklung, die Schaden für die kleine Patientengruppe verhindern könnte, die gegenüber immunvermittelten Leberverletzungen anfällig ist.
Je weiter Organoid-Plattformen reifen, desto mehr müssen Regulierungsbehörden, Industrie und klinische Forschung zusammenarbeiten, um diese Systeme zu validieren und in Sicherheitsprüf-Pipelines zu integrieren. Gelingt dies, wird die nächste Generation präklinischer Tests menschlicher, besser prädiktiv und effektiver beim Schutz vor seltenen, aber schweren unerwünschten Arzneimittelwirkungen.
Zusammenfassend bietet die Kombination aus iPSC‑basierten Leberorganoiden, autologen Immunzellen und automatisierter Microarray‑Technologie eine robuste Grundlage für prädiktive Toxikologie. Sie verbindet molekulare Mechanismenforschung mit praktischen Anwendungen in der Wirkstoffentwicklung und eröffnet Wege zu personalisierten Sicherheitsmaßnahmen, frühzeitigen Risikofilterungen und optimierten klinischen Studien.
Quelle: sciencedaily

Kommentar hinterlassen