7 Minuten
Eine routinemäßige Aufnahme des Augenhintergrundes könnte als Frühwarnsystem für kardiovaskuläre Erkrankungen dienen und außerdem aufzeigen, wie schnell jemand biologisch altert. Neue Forschung, die Netzhautbilder, genetische Daten und Blut-Biomarker kombiniert, weist auf messbare Signale in winzigen Netzhautgefäßen hin, die die Gefäßgesundheit im gesamten Körper widerspiegeln.
Kleine Gefäße, große Hinweise: warum die Netzhaut matter
Die Netzhaut ist einer der wenigen Orte im Körper, an denen Ärztinnen und Ärzte die Mikrogefäße non-invasiv und direkt beobachten können. Forschende vermuten seit Langem, dass Veränderungen in den Gefäßmustern der Netzhaut auf weiterreichende Probleme im Kreislaufsystem hinweisen. Die aktuelle Studie, veröffentlicht in Science Advances, stärkt diesen Zusammenhang und zeigt, dass einfachere, weniger verzweigte Netzhautgefäßnetzwerke mit einer höheren genetischen Prädisposition für Herz-Kreislauf-Erkrankungen und beschleunigtem biologischen Altern verbunden sind.
Für die Untersuchung analysierten die Wissenschaftlerinnen und Wissenschaftler Augenaufnahmen und genetische Informationen von mehr als 74.000 Freiwilligen. Sie verwendeten eine Methode namens Mendelsche Randomisierung, um kausale Zusammenhänge zu testen. Diese Methode setzt feste genetische Varianten als Instrumentvariable für einen Gesundheitszustand ein und erlaubt so eine bessere Trennung von Ursache und Korrelation. Da unsere Gene sich im Laufe des Lebens nicht ändern, sind mit dieser Methode gefundene Assoziationen eher Hinweis auf zugrundeliegende Mechanismen als auf zufällige Verknüpfungen.
Was das Team herausfand und warum es wichtig ist
Die Analyse ergab, dass Personen mit geringerer Komplexität der Netzhautgefäße — gemessen an einer niedrigeren Fraktal-Dimension bzw. einfacherer Verzweigung — zugleich ein erhöhtes genetisches Risiko für Herzkrankheiten tragen. Dies deutet darauf hin, dass gemeinsame biologische Signalwege sowohl die vaskuläre Degeneration in der Netzhaut als auch das erhöhte kardiovaskuläre Risiko im restlichen Körper vorantreiben.
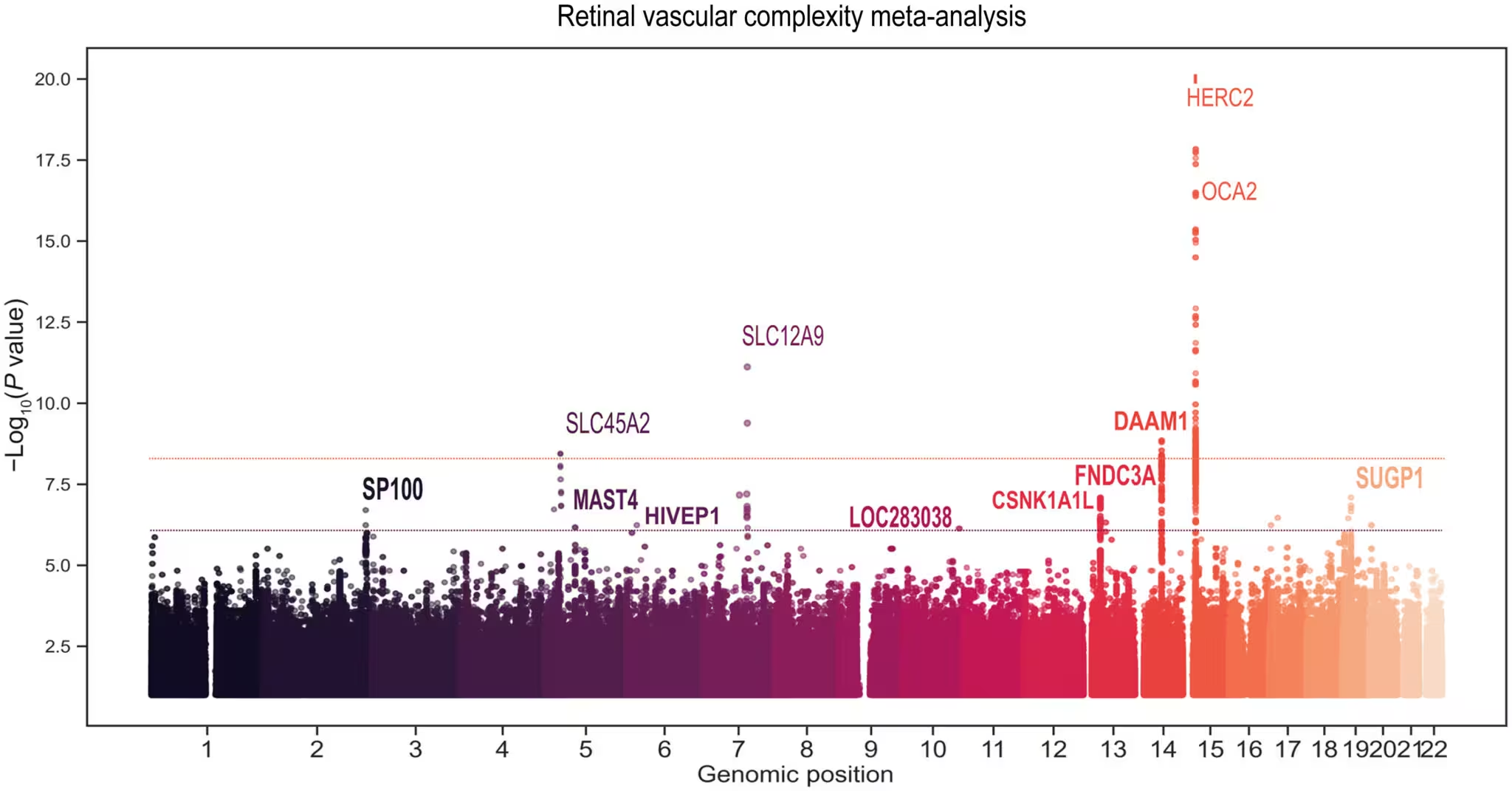
Neben Bildgebung und Genetik nutzte die Studie eine weitere Kohorte, um Blutproteine zu scannen und Moleküle zu identifizieren, die diese Veränderungen vermitteln könnten. Zwei Proteine traten deutlich hervor: MMP12, ein Enzym, das mit Gewebeumbau und Entzündungsprozessen assoziiert ist, sowie der IgG–Fc-Rezeptor IIb, ein Immunrezeptor, der Entzündungsreaktionen modulieren kann. Beide Moleküle scheinen die Struktur kleiner Gefäße zu beeinflussen und könnten potenziell als Targets für präventive Therapien dienen, die das vaskuläre Altern verlangsamen sollen.
Die Studie liefert damit mehrere Ebenen belastbarer Hinweise: erstens die Bildgestützte Messung von Gefäßmustern, zweitens genetische Signale, die kausale Zusammenhänge nahelegen, und drittens proteinbiologische Marker, die als Mechanismen fungieren könnten. Zusammengenommen stärken diese Ergebnisse die Hypothese, dass die Netzhaut als Spiegel für systemische Gefäßveränderungen dienen kann.
„Das Auge bietet eine einzigartige, nicht-invasive Einsicht in das Kreislaufsystem des Körpers“, sagt Marie Pigeyre, Genetikerin an der McMaster University. „Veränderungen in den Netzhautgefäßen spiegeln oft Veränderungen, die in den kleinen Gefäßen des gesamten Körpers stattfinden.“ Die Erklärung ihres Teams unterstreicht, wie Netzhaut-Screenings die Risikobewertung von aufwendigen Laboruntersuchungen hin zu einer schnellen klinischen Bildaufnahme verlagern könnten.
Vom Labor in die Klinik: Chancen und Herausforderungen
Gegenwärtige Einschätzungen altersbedingter vaskulärer Erkrankungen — einschließlich Herzkrankheiten, Schlaganfall und Demenz — stützen sich häufig auf umfangreiche Blutuntersuchungen, bildgebende Verfahren und detaillierte Anamnesen. Falls die Befunde in breiteren Bevölkerungsgruppen validiert werden, könnten Netzhautaufnahmen eine schnellere und kostengünstigere erste Screening-Stufe darstellen. Ein einfaches Beispiel: Wird die Netzhautfotografie in Routineuntersuchungen integriert, könnten Ärztinnen und Ärzte frühzeitig Personen identifizieren, die von Lebensstilinterventionen, engmaschiger Überwachung oder gezielten Therapien profitieren.
Dennoch bestehen mehrere Hürden, bevor Retina-Scans flächendeckend als Screening-Instrument eingesetzt werden. Zum einen müssen die Bildgebungsgeräte und die Auswertealgorithmen standardisiert werden, damit Ergebnisse zwischen Kliniken vergleichbar sind. Zum anderen bedarf es klarer klinischer Leitlinien: Ab wann soll ein auffälliges Netzhautmuster eine weitergehende kardiovaskuläre Abklärung auslösen? Zudem sind prospektive klinische Studien notwendig, um zu zeigen, dass auf Retinamarker basierende Interventionen tatsächlich zu einer Reduktion von Herzinfarkten, Schlaganfällen oder anderen Endpunkten führen.
Praktische Implementierungsfragen betreffen zudem die Integration in elektronische Patientenakten, die Ausbildung von Fachpersonal und die Kosten-Nutzen-Analyse. Auch ethische und datenschutzrechtliche Aspekte müssen berücksichtigt werden: Genetische Informationen, biomarkerbasierte Risikovorhersagen und automatisierte Bildanalyse erfordern transparente Kommunikation und strengen Schutz persönlicher Daten.
Verwandte Technologien und Zukunftsaussichten
Fortschritte im maschinellen Lernen ermöglichen bereits heute die automatisierte Analyse von Netzhautfotos zur Detektion diabetischer Retinopathie und altersbedingter Makuladegeneration. Die nächste Entwicklungsstufe besteht darin, diese Algorithmen so zu erweitern, dass sie vaskuläre Fraktal-Dimensionen quantifizieren, Auffälligkeiten klassifizieren und genetische sowie proteomische Risikofaktoren integrieren können. Solche multimodalen Screeningplattformen könnten die Sensitivität und Spezifität der Risikoabschätzung deutlich verbessern.
Blutbasierte Biomarker wie MMP12 und der IgG–Fc-Rezeptor IIb könnten in mehrstufige Risikoscores einfließen, die Bilddaten, Genetik und Proteomik kombinieren. Solche Scores wären nützlich, um Hochrisikogruppen zu priorisieren, klinische Studien besser zu stratifizieren und die Medikamentenentwicklung zu fokussieren — etwa für Wirkstoffe, die gezielt vaskuläre Entzündung und Gewebeumbau adressieren.
Technisch gesehen erfordert die Messung der Fraktal-Dimension robuste Bildvorverarbeitungsschritte: Kontrastnormalisierung, Segmentierung der Gefäßstruktur, Eliminierung von Artefakten und konsistente Messmethoden. Forschende arbeiten an standardisierten Pipelines, die reproduzierbare Fraktalmessungen erlauben. Zusätzlich sind Validierungsstudien über verschiedene Populationen und Altersgruppen hinweg nötig, um mögliche Confounder wie systemische Entzündungsmarker, Blutdruck, Cholesterin und Stoffwechselerkrankungen zu berücksichtigen.
Langfristig könnten mobile Retinakammern, Telemedizinlösungen und cloudbasierte KI-Analysen die Zugänglichkeit erhöhen. In strukturschwachen Regionen mit begrenztem Zugang zu spezialisierten Zentren könnten solche Technologien besonders wertvoll sein, um kardiovaskuläre Risikopopulationen frühzeitig zu identifizieren und präventiv zu intervenieren.
Fachliche Einschätzung
Dr. Elena Ramirez, eine kardiovaskuläre Forscherin, die nicht an der Studie beteiligt war, kommentiert: „Diese Arbeit verknüpft elegant Bildgebung, Genetik und Proteomik. Sie bringt das Netzhaut-Scanning über die Augenheilkunde hinaus in die Vorhersage systemischer Risiken. Der nächste Schritt sind prospektive Studien, die testen, ob frühzeitiges Handeln basierend auf Netzhaut-Signalen Herzinfarkte oder Schlaganfälle verhindern kann.“
Für Kliniker und Forschende eröffnet die Netzhaut damit ein praktikables Fenster zum Verständnis des vaskulären Alterns. Mit verbesserten Bildgebungs- und Biomarker-Panels könnten Netzhautscans künftig standardmäßig in die Präventionsmedizin einfließen — so dass kardiovaskuläre Risiken früher erkannt und Interventionen gezielter auf das biologische Alter des Gefäßsystems abgestimmt werden.
Ergänzend zu den bereits genannten Punkten ist es wichtig, die Rolle von Lebensstilfaktoren zu betonen: Rauchen, ungesunde Ernährung, Bewegungsmangel und chronischer Stress sind bekannte Treiber von Gefäßschäden. Retinale Parameter könnten als sensitive Indikatoren dienen, um die Wirksamkeit von Lebensstil-Interventionen zu überwachen und individualisierte Präventionspläne zu entwickeln. Ebenfalls relevant ist die pharmakologische Perspektive: Studien zu entzündungshemmenden Strategien und MMP-Inhibitoren könnten zeigen, ob gezielte Medikamente das vaskuläre Altern verlangsamen und retinale Gefäßmuster stabilisieren.
Außerdem eröffnen sich epidemiologische Anwendungen: Große bevölkerungsbasierte Kohorten mit Netzhautbildern, genetischen Profilen und Längsschnittdaten würden es ermöglichen, Risikomodelle zu kalibrieren, Populationsunterschiede zu untersuchen und Interaktionen zwischen Genetik und Umweltfaktoren zu analysieren. Solche Daten würden die Aussagekraft retinärer Marker für die Vorhersage klinischer Endpunkte weiter stärken.
Schließlich ist die interdisziplinäre Zusammenarbeit entscheidend: Ophthalmologen, Kardiologen, Genetiker, Bioinformatiker und Gesundheitsökonomen müssen zusammenarbeiten, um die wissenschaftlichen Erkenntnisse in praktikable, sichere und gerechte Versorgungswege zu überführen. Nur so lässt sich das volle Potenzial von Netzhaut-Screenings für die Prävention kardiovaskulärer Erkrankungen realisieren.
Quelle: sciencealert

Kommentar hinterlassen