8 Minuten
Forscher haben eine spezialisierte Klasse von CD4-Immunzellen identifiziert, die seneszente Zellen erkennen und zerstören — die sogenannten „Zombie“-Zellen, die sich mit dem Alter ansammeln und chronische Entzündungen antreiben. Die Entdeckung, geleitet von der Ben-Gurion-Universität des Negev, legt nahe, dass das Immunsystem sich an das Altern anpasst, indem es gezielte Effektor-Zellen bildet, die Gewebeschäden in Schach halten.
Wie das Immunsystem sich an das Altern anpasst
Zellen, die in Seneszenz eintreten, hören auf sich zu teilen, sondern geben weiterhin entzündungsfördernde Moleküle ab, die das umliegende Gewebe verändern. Dieser Prozess — die zelluläre Seneszenz — trägt über Jahre hinweg zu Gewebevernarbung, Organfunktionsstörungen und einer chronischen, niedriggradigen Entzündung bei, die häufig als „inflammaging“ bezeichnet wird. Wissenschaftler vermuteten schon lange, dass das Immunsystem eine Rolle bei der Beseitigung dieser schädlichen Zellen spielt, doch die genauen Akteure und Mechanismen blieben unklar.
Die neue Studie identifiziert sogenannte CD4-Eomes-Zellen, eine Variante der Helfer-T-Zellen, die das Transkriptionsfaktorprotein Eomes exprimieren, als eine vordere Verteidigungslinie gegen seneszente Zellen. Durch den Vergleich von Immunzellen junger und alter Mäuse fand das Team zwei entscheidende Muster: Die Präsenz seneszenter Zellen löst bei CD4-T-Zellen die Ausbildung des CD4-Eomes-Profils aus, und genetisch veränderte Mäuse, die diese Spezialisierung nicht ausbilden können, akkumulieren vermehrt seneszente Zellen. Kurz gesagt: CD4-Eomes-Zellen scheinen eine adaptive Antwort auf die wachsende Last an seneszenten Zellen zu sein, die mit dem Alter zunimmt.
Mechanistisch deuten die Ergebnisse darauf hin, dass seneszente Zellen über ihr sekretorisches Profil — das sogenannte Senescence-Associated Secretory Phenotype (SASP) — spezifische Signale aussenden, die naive oder bereits aktivierte CD4-T-Zellen umprogrammieren. Diese Umprogrammierung umfasst eine erhöhte Expression von Eomesodermin (Eomes), veränderte Zytokinprofile und eine gesteigerte zytotoxische Kapazität, die zuvor eher mit CD8-T-Zellen oder NK-Zellen assoziiert wurde. Die Identifikation solcher Übergangsphänotypen erweitert unser Verständnis von T-Zell-Plastizität und Immunanpassung bei der Alterung.
Wichtig für die Altersforschung ist, dass diese adaptive Immunantwort nicht notwendigerweise ein Zeichen dysregulierter Immunüberaktivität ist, sondern als gezielte, regulierte Säuberungsfunktion interpretiert werden kann. Eine differenzierte Betrachtung biologischer Alterungsprozesse legt nahe, dass das Immunsystem dynamisch auf kumulative Zellschäden reagiert — ein Konzept, das immunologische Anpassung an statt reines Funktionsversagen betont.
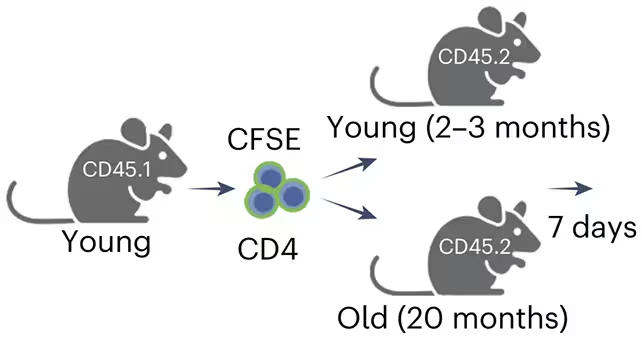
Belege aus Experimenten und Krankheitsmodellen
Um die Funktionalität zu prüfen, übertrugen die Forschenden CD4-T-Zellen von jungen Tieren in sowohl junge als auch gealterte Empfänger und verfolgten die Ergebnisse longitudinal. In Situationen, in denen CD4-Eomes-Spezialisierungen verfügbar waren, sanken die Zahlen seneszenter Zellen und Markersysteme für Gewebeschädigung verbesserten sich. Diese Schutzwirkung zeigte sich nicht nur in gesunden Geweben, sondern auch in Modellen chronischer Erkrankungen: In einem Mausmodell der Leberzirrhose begrenzte die Präsenz von CD4-Eomes-Zellen die Fibrose und verringerte die Anzahl seneszenter Zellen in geschädigtem Lebergewebe.
Solche funktionellen Übertragungs- und Ablationsstudien liefern direkte Hinweise darauf, dass CD4-Eomes-Zellen aktiv zur Kontrolle seneszenter Zellen beitragen. In genetisch veränderten Mäusen, denen die Fähigkeit zur Ausbildung dieses Subtyps fehlte, proliferierten seneszente Zellen stärker, was die These stützt, dass diese Immununtergruppe für den Erhalt des Gewebes im Alterungsprozess essenziell ist.
Darüber hinaus wurden phänotypische und molekulare Analysen durchgeführt, um Rezeptoren, Zytokine und Effektor-Moleküle zu charakterisieren, die mit CD4-Eomes assoziiert sind. Studien zeigten eine Querschnittsaktivität von Perforin/Granzyme-Wegen, erhöhte Produktion von Interferon-gamma und eine veränderte Expression von Checkpoint-Molekülen, die auf eine fein abgestimmte, aber effektive zytotoxische Funktion hindeuten. Solche Befunde sind wichtig, um potenzielle Mechanismen zu identifizieren, die selektiv seneszente Zellen eliminieren, ohne gesunde Zellen anzugreifen.
Zusätzlich nutzten die Forschenden bildgebende und histologische Methoden, um lokale Veränderungen in Entzündungsinfiltraten und Gewebestruktur zu quantifizieren. In den analysierten Proben korrelierte die Häufigkeit von CD4-Eomes-Zellen invers mit Markern für Gewebsdegeneration, was die funktionale Relevanz dieser Zellen in situ unterstützt.
Warum das für Anti-Aging-Forschung wichtig ist
Viele Verjüngungsstrategien gehen davon aus, dass eine Rückführung eines gealterten Immunsystems in einen „jugendlichen“ Zustand der Schlüssel zur Umkehr altersbedingter Funktionsverluste ist. Die Arbeiten des Ben-Gurion-Teams warnen jedoch vor einer solchen eindimensionalen Sichtweise. Ein immunologisches Profil, das CD4-Eomes-Zellen einschließt, kann gerade bei älteren Individuen vorteilhaft sein; eine radikale „Neuanlage“ des Immunsystems könnte daher nützliche, adaptierte Abwehrmechanismen entfernen.
Die Studienautoren schlagen vor, dass das Ziel nicht ein künstlich überaktives Immunsystem sein sollte, sondern eines, das für die jeweilige Lebensphase geeignet kalibriert ist — also effektiv seneszente Zellen entfernt, ohne eine schädigende, autoimmunähnliche Entzündungsreaktion zu fördern. Dieses differenzierte Ziel erfordert ein Verständnis der Balance zwischen Immunüberwachung, Gewebehomöostase und systemischer Entzündungsregulation.
Für therapeutische Konzepte bedeutet das: Anstatt das Immunsystem global zu „verjüngen“, könnten präzisere Ansätze verfolgt werden, die adaptive Komponenten wie CD4-Eomes fördern oder modulieren. Solche Strategien würden auf gezielte Immunmodulation abzielen, um die zelluläre Seneszenz zu reduzieren, ohne die Gefahr unerwünschter Nebenwirkungen wie Autoimmunität oder chronische Hyperinflammation zu erhöhen.
In der Diskussion um Senolytika — Arzneimittel, die selektiv seneszente Zellen eliminieren — eröffnen CD4-Eomes-basierte Mechanismen eine ergänzende Perspektive: Statt ausschließlich pharmakologische Senolytika einzusetzen, könnte eine kombinierte Vorgehensweise mit immunologischen Verstärkern die Effizienz der Seneszenzbeseitigung verbessern und gleichzeitig die Gewebereparatur unterstützen. Allerdings bleibt offen, wie solche Kombinationen sicher und effektiv in klinischen Kontexten umgesetzt werden können.
Nächste Schritte und translationale Perspektiven
Wesentliche Fragen bleiben offen: Bilden menschliche Immunsysteme CD4-Eomes-Zellen in vergleichbarer Weise aus, und wenn ja, wie beeinflussen Genetik, Umweltfaktoren, Infektionsgeschichte und Komorbiditäten deren Aktivität? Das Forschungsteam plant, CD4-Eomes-Antworten in menschlichen Geweben zu kartieren, etwa in Blut, Leberbiopsien und altersassoziierten Organproben, sowie Single-Cell-Analysen und räumliche Transcriptomik einzusetzen, um die Lokalisation und Funktion dieser Zellen präzise zu bestimmen.
Die Translation von Mausbefunden auf den Menschen erfordert mehrere Validierungsschritte: Identifikation vergleichbarer Markerprofile bei Menschen, funktionelle Tests ex vivo (z. B. Co-Kultur-Assays mit menschlichen seneszenten Zellen) und schließlich kontrollierte klinische Studien. Forscher betonen die Notwendigkeit von Sicherheitsstudien, um mögliche Off-Target-Effekte zu minimieren — insbesondere das Risiko, dass verstärkte zytotoxische Aktivität gesunde Gewebe schädigt oder inflammatorische Zustände verschlimmert.
Wenn sich Therapien entwickeln ließen, die CD4-Eomes-Funktionen gezielt verstärken oder rekrutieren, könnten sie bestehende Ansätze wie Senolytika ergänzen. Mögliche interventionalle Strategien umfassen adoptive Zelltherapien (d. h. Ex-vivo-verstärkte CD4-Eomes-ähnliche Zellen), Impfstoff-ähnliche Ansätze zur Förderung endogener Antwort oder kleine Moleküle/biologisches, die Eomes-Expression und zytotoxische Programme in CD4-T-Zellen induzieren.
Gleichzeitig betonen die Autoren die Notwendigkeit einer präzisen Patientenselektion: Altersbedingte Immunsysteme sind heterogen — Faktoren wie chronische Viren (z. B. CMV), metabolische Erkrankungen oder frühere Immuntherapien können die Reaktionsfähigkeit beeinflussen. Personalisierte Biomarker könnten daher helfen, diejenigen Patienten zu identifizieren, die von einer CD4-Eomes-basierten Modulation am meisten profitieren würden.
Aus wissenschaftlicher Sicht eröffnet die Entdeckung ein neues Forschungsfeld, das zelluläre Seneszenz, Inflammation und Immun-Spezialisierung verknüpft. Weitere Studien werden notwendig sein, um Wirkmechanismen, Langzeiteffekte und Interaktionen mit anderen Immunkompartimenten wie NK-Zellen, Makrophagen und CD8-T-Zellen zu beleuchten.
Insgesamt rahmt die Entdeckung das Altern als ein dynamisches Zusammenspiel zwischen kumulativen Zellschäden und immunologischer Anpassung. Dies liefert nicht nur ein tieferes Verständnis von Immunologie und Alterung, sondern benennt auch neue therapeutische Ansatzpunkte für die Bekämpfung altersassoziierter Erkrankungen und inflammatorischer Zustände.
Schlüsselbegriffe und zentrale Konzepte dieser Forschung umfassen: zelluläre Seneszenz, SASP, inflammaging, Immunanpassung, CD4-T-Zell-Plastizität, Eomesodermin, Senolytika, Gewebehomöostase und translationale Altersforschung. Die sorgfältige Integration dieser Konzepte wird für die weitere Entwicklung von sicheren und wirksamen Interventionsstrategien entscheidend sein.
Forscher und Klinikpartner sind daher aufgerufen, multidisziplinär zusammenzuarbeiten — Immunologen, Gerontologen, Molekularbiologen und klinische Studienzentren — um die pathophysiologischen Grundlagen zu verifizieren und klinisch relevante Anwendungen verantwortungsvoll zu entwickeln. Solche Kooperationen sollten ethische, regulatorische und sicherheitsrelevante Aspekte von immunmodulatorischen Anti-Aging-Strategien von Anfang an berücksichtigen.
Quelle: sciencealert

Kommentar hinterlassen