7 Minuten
Forscher in Japan berichten, dass orales Arginin — eine Aminosäure, die bereits bei Brustschmerzen und Bluthochdruck eingesetzt wird — Amyloid‑beta-Proteinaggregate bei Mäusen und Fruchtfliegen beseitigt hat. Der Befund, veröffentlicht in Neurochemistry International, deutet auf einen kostengünstigen und klinisch gut verträglichen Kandidaten hin, der für weitere Untersuchungen gegen ein zentrales molekulares Merkmal der Alzheimer-Krankheit infrage kommt.
Warum Arginin Proteinaggregate anvisieren könnte
Amyloid‑beta-Plaques sind klebrige Proteinaggregate, die seit langem mit der Pathologie der Alzheimer-Krankheit in Verbindung gebracht werden. Sie lagern sich im interstitiellen Raum zwischen Neuronen ab und stehen im Zusammenhang mit synaptischer Dysfunktion und dem neuronalem Zelltod. Arginin ist dafür bekannt, als chemisches Chaperon zu wirken — ein kleines Molekül, das Proteine beim korrekten Falten unterstützt oder verhindert, dass sie falsch falten und zusammenkleben.
Diese Eigenschaft bildet den Kern der Hypothese der neuen Studie: Wenn Arginin sowohl bestehende Aggregate auflösen als auch die Bildung neuer Klumpen verhindern kann, könnte es eines der sichtbarsten molekularen Kennzeichen von Alzheimer reduzieren. Für zerebrale Therapien ist es außerdem entscheidend, dass frühere Arbeiten gezeigt haben, dass Arginin die Blut-Hirn-Schranke überwinden kann — eine große Hürde für neuroaktive Wirkstoffe.
Als Vorläufer für Stickstoffmonoxid (NO) hat Arginin zusätzliche biologisch relevante Effekte, die Immunantworten und vaskuläre Funktionen modulieren können. Diese multifunktionalen Wirkmechanismen — direkte Wirkung auf Proteinaggregation kombiniert mit Einflüssen auf Entzündungsprozesse und vaskuläre Signale — machen Arginin zu einem potenziell vielseitigen Kandidaten gegen Proteinfehlfaltungserkrankungen wie Alzheimer.
Studiendesign: Tiere, Dosierung und gemessene Ergebnisse
Ein Forscherteam der Kindai University und des Japan National Institute of Neuroscience züchtete männliche Mäuse, die genetisch so verändert wurden, dass sie Alzheimer-ähnliche Amyloid‑beta-Ablagerungen entwickeln. Anstelle invasiver Verabreichungswege gaben die Wissenschaftler Arginin über das Trinkwasser der Tiere — eine orale Route, die dem Weg entspricht, auf dem Patientinnen und Patienten eine mögliche zukünftige Therapie einnehmen würden.
Parallel zu den Mausversuchen führten die Forschenden ergänzende Experimente an Fruchtfliegen (Drosophila) sowie in vitro-Assays durch, um die Effekte von Arginin auf die Amyloid‑beta-Aggregation direkter zu erfassen. Diese parallelen Ansätze erlaubten es, systemische Effekte (beispielsweise Änderungen in der Entzündungsreaktion) von direkten Effekten auf Proteinaggregate zu unterscheiden.
Die Studie verwendete vielfache Ausleseparameter: histologische Bewertung von Amyloid‑Plaques, biochemische Messungen fibrillärer Strukturen, molekulare Analysen von Entzündungsgenen sowie Verhaltensprüfungen bei Mäusen zur Erfassung kognitiver und motorischer Veränderungen. Solche kombinierten Endpunkte sind wichtig, um sowohl mechanistische Aussagen als auch funktionelle Effekte zu prüfen.
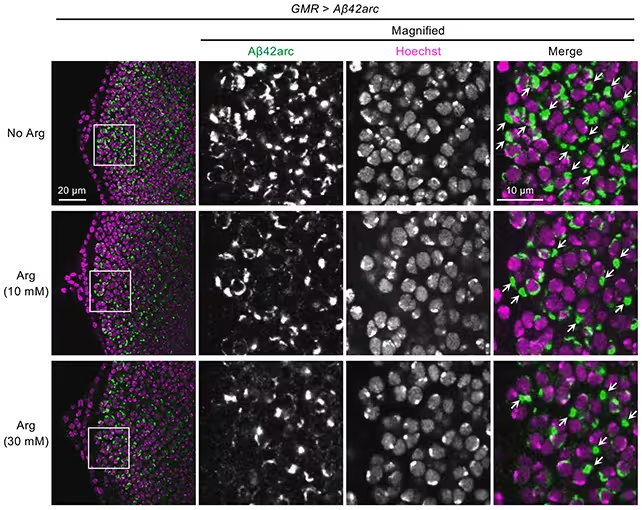
Arginin reduzierte Amyloid‑beta‑Verklumpungen (in grün) in Fruchtfliegen-Modellen.
Wesentliche Ergebnisse und biologische Signale
Mäuse, die Arginin erhielten, zeigten deutlich weniger Amyloid-Ablagerungen im Gehirn und wiesen in standardisierten Verhaltensprüfungen geringere Defizite auf. Molekulare Analysen dokumentierten zudem eine Abschwächung der Aktivität neuroinflammatorischer Gene, was darauf hindeutet, dass die Behandlung mehr leisten könnte als nur Plaques aufzulösen — sie könnte auch nachgelagerte Entzündungsreaktionen minimieren, die zum neuronalen Schaden beitragen.
Die in vitro-Experimente und die Ergebnisse aus den Fruchtfliegen bestätigten einen direkten Anti-Aggregations-Effekt: Arginin schien bestehende Fibrillen zu klären und gleichzeitig die Neubildung von Amyloid‑beta zu begrenzen. Zusammengenommen sprechen diese Ergebnisse für einen Doppelwirkungsmechanismus — Arginin als chemisches Chaperon einerseits und als Modulator entzündlicher Signalwege andererseits.
Vertiefte Analysen legen nahe, dass Arginin die Proteostase beeinflussen kann, also die zellulären Mechanismen des Proteinhandlings wie Chaperon-vermittelte Faltung, Ubiquitin‑Proteasom-System und Autophagie. Eine Verbesserung dieser Systeme könnte helfen, fehlgefaltete Proteine effizienter zu entfernen und so die Bildung toxischer Aggregate zu reduzieren.
Zusätzlich deuten einige Befunde darauf hin, dass Arginin über seine Rolle als NO‑Vorläufer Gefäßfunktionen und Mikroglia-Aktivität moduliert — Mechanismen, die bei neurodegenerativen Erkrankungen oft gestört sind. Die Kombination dieser Effekte könnte erklären, warum sowohl strukturelle Plaqueminderung als auch positive Veränderungen in Entzündungsmarkern beobachtet wurden.
Was das bedeutet — und was es nicht bedeutet
Leitender Neurowissenschaftler Yoshitaka Nagai fasste die Bedeutung so zusammen: 'Unsere Studie zeigt, dass Arginin die Amyloid‑beta-Aggregation sowohl in vitro als auch in vivo unterdrücken kann. Entscheidend ist, dass Arginin bereits als klinisch sicher und kostengünstig bekannt ist, was es zu einem vielversprechenden Kandidaten für ein Repositionierungs-Programm bei der Alzheimer-Therapie macht.'
Dennoch mahnen die Autorinnen und Autoren sowie unabhängige Kommentatorinnen zur Vorsicht. Die Tierstudien wurden mit relativ hohen Arginin-Dosen durchgeführt; sichere und effektive Dosierungen für Menschen sind noch nicht etabliert. Zudem sind Maus- und Fliegenmodelle nützliche, aber unvollständige Abbildungen der komplexen Humanerkrankung Alzheimer. Viele Interventionen, die in Tiermodellen erfolgreich waren, haben in klinischen Studien nicht die erwarteten kognitiven Vorteile erbracht.
Ein grundlegender wissenschaftlicher Streit besteht zudem darin, dass das Entfernen von Amyloid-Plaques nicht konsequent zu klinischer Besserung geführt hat. Das wirft die Frage auf, ob Plaques treibende Ursachen der Krankheit sind oder eher Folgeprozesse widerspiegeln. Vor diesem Hintergrund könnten Arginins ergänzende antiinflammatorische Effekte und seine möglichen positiven Auswirkungen auf die Proteostase mindestens genauso relevant sein wie die Plaque-Reduktion selbst.
Praktisch gesehen heißt das: Plaquereduktion ist ein wichtiger, aber nicht hinreichender Indikator für therapeutischen Nutzen. Klinische Studien müssen daher breit gefasste Endpunkte berücksichtigen, darunter kognitive Tests, Biomarker für Neurodegeneration und Neuroinflammation sowie Sicherheits- und Verträglichkeitsdaten.
Expertinnen- und Experteneinschätzung
Dr. Maria Chen, eine Neuropharmakologin, die nicht an der Studie beteiligt war, kommentierte: 'Das ist eine elegante und pragmatische Studie. Die orale Verabreichungsform und das bekannte Sicherheitsprofil machen Arginin zu einem logischen Kandidaten für eine beschleunigte Übersetzung in frühe klinische Studien. Dennoch müssen klinische Endpunkte Kognition und Biomarker jenseits der Plaquelast umfassen, um echten Patientennutzen nachzuweisen.'
Weitere notwendige Schritte sind Dosisfindungsstudien beim Menschen, umfassende Sicherheitsbewertungen und anschließend sorgfältig konzipierte klinische Studien, die kognitive Ergebnisse, Amyloid-Biomarker sowie Marker der Neuroinflammation messen. Sollte es gelingen, multiple pathologische Prozesse bei akzeptabler Sicherheit zu beeinflussen, könnte Arginin Teil eines wachsenden Portfolios von Strategien gegen Proteinfehlfaltungsstörungen werden.
Darüber hinaus ist denkbar, dass Arginin in Kombination mit anderen Therapieansätzen getestet werden sollte — etwa mit Antikörpern gegen Amyloid‑β, kleinen Molekülen, die Proteasom- oder Autophagiepfade modulieren, oder mit Anti‑Entzündungsstrategien. Solche kombinierten Ansätze könnten synergistische Effekte zeigen, indem sie sowohl die Ursachen als auch die Folgeprozesse der Neurodegeneration adressieren.
Abschließend bleibt festzuhalten: Arginin ist noch keine nachgewiesene Therapie gegen Alzheimer, doch die Tierdaten liefern eine fundierte Begründung für die nächste Phase klinischer Forschung. Sie erinnern zudem daran, dass die Repositionierung kostengünstiger, gut untersuchter Moleküle manchmal schnelle Wege zu neuen Behandlungsmöglichkeiten eröffnen kann.
Für die Übersetzung dieser Ergebnisse in die Klinik sind Transparenz in der Datenberichterstattung, Reproduzierbarkeit und die strenge Bewertung von Sicherheitsprofilen entscheidend. Replikationsstudien, präklinische Arbeiten zu Wirkmechanismen und erste Humanversuche werden klären müssen, ob Arginin das Potenzial hat, sich zu einem praktikablen Baustein in der Alzheimer‑Therapie zu entwickeln.
Quelle: sciencealert

Kommentar hinterlassen