6 Minuten
Alzheimer neu denken: eine Immunfehlsteuerung im Gehirn
Die Alzheimer-Krankheit wird zunehmend nicht allein als klassische Proteinopathie betrachtet, sondern auch als Erkrankung, die wesentlich von der Immunantwort des Gehirns mitbestimmt sein könnte. In dieser sich etablierenden Sichtweise verwechseln Immunzellen im zentralen Nervensystem neuronale Komponenten mit fremden Eindringlingen und lösen eine anhaltende Abwehrreaktion aus. Diese chronische neuroinflammatorische Aktivität beeinträchtigt schrittweise die neuronale Funktion und führt über Monate bis Jahre zu einem fortschreitenden Verlust von Gedächtnis, Denkvermögen und Alltagskompetenz — den charakteristischen Merkmalen einer Demenz.
Im Zentrum dieses Ansatzes steht die zweigleisige Rolle des Beta-Amyloids. Lange Zeit galt Beta-Amyloid vor allem als zentraler Bestandteil der Amyloid-Plaques. Neuere experimentelle und epidemiologische Befunde deuten jedoch darauf hin, dass Beta-Amyloid auch eine antimikrobielle oder immununterstützende Funktion haben kann: Es neutralisiert potenziell schädliche Mikroorganismen und stärkt angeborene Abwehrmechanismen im Gehirn. Problematisch wird es, wenn Beta-Amyloid sich anhäuft oder die Regulation gestört ist; dann kann es Immunreaktionen verstärken und eine selbstgerichtete Entzündungsreaktion gegen neuronales Gewebe aufrechterhalten. Ein autoimmunähnlicher Prozess dieser Art könnte erklären, warum klassische systemische Immunsuppressiva, etwa Kortikosteroide, die bei rheumatoider Arthritis wirken, in klinischen Studien bei Alzheimer nur begrenzten Nutzen zeigen — die Immunumgebung des Gehirns und die dort wirksamen Regulatoren sind einzigartig und erfordern spezifische therapeutische Ansätze.
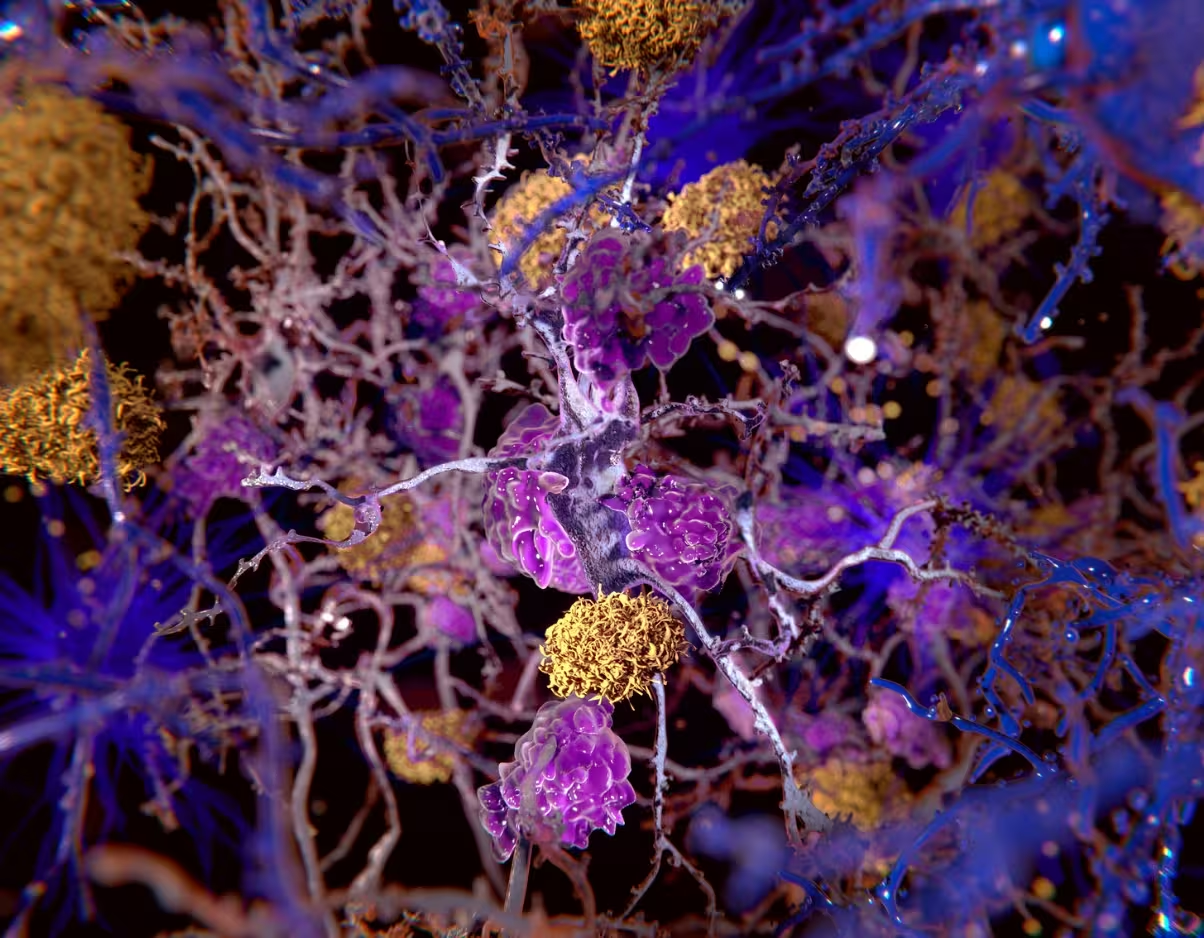
Illustration von Beta-Amyloid-Plaques (gelb) zwischen Neuronen.
Wissenschaftlicher Hintergrund und alternative Hypothesen
Die moderne Alzheimer-Forschung erweitert den Blickwinkel über eine einzige Ursache hinaus. Eine Vielzahl sich ergänzender und konkurrierender Theorien versucht, die komplexe Pathophysiologie zu erklären. Diese Hypothesen lassen sich miteinander verknüpfen und erzeugen ein multifaktorielles Bild, in dem Immunmechanismen, Stoffwechselstörungen und exogene Faktoren zusammenwirken.
- Mitochondriale Dysfunktion: Mitochondrien sind die zellulären Kraftwerke, die Sauerstoff und Glukose in ATP umwandeln. Kommt es in Neuronen zu einem Funktionsverlust der Mitochondrien, entsteht ein Energieengpass, der synaptische Übertragung, Plastizität und zelluläre Reparaturmechanismen beeinträchtigt. Energiedefizite erhöhen oxidativen Stress, fördern Proteinfehlfaltung und können neurodegenerative Prozesse beschleunigen.
- Chronische Infektion: Manche Forscher vermuten, dass wiederkehrende oder persistente Infektionen — einschließlich oraler Erreger, Herpes-simplex-Viren oder anderer Mikroben — entzündliche Signalwege im Gehirn aktivieren, die über Jahre zu neuronaler Schädigung führen. In dieser Perspektive könnte Beta-Amyloid zunächst als Teil der antimikrobiellen Antwort gebildet werden und später eine pathologische Rolle übernehmen.
- Metallstoffwechsel-Störung: Die gestörte Handhabung essentieller Metalle wie Zink, Kupfer oder Eisen kann die neuronale Biochemie verändern. Metallionen beeinflussen Enzymaktivitäten, Proteinaggregation und oxidative Reaktionen. Eine Dysregulation kann die Bildung toxischer Proteinaggregate fördern und Entzündungsprozesse begünstigen.
Diese Hypothesen schließen sich nicht gegenseitig aus. Beispielsweise kann eine chronische Infektion die Produktion von Beta-Amyloid als Schutzantwort stimulieren; bei genetischer oder altersbedingter Vulnerabilität kann dies jedoch in eine schädliche, selbstverstärkende Entzündung übergehen. Die Interaktion von Genetik (z. B. APOE-Genvarianten), Alterungsprozessen, vaskulären Faktoren und Umweltfaktoren erzeugt ein komplexes Risikoprofil für die Entstehung von Alzheimer-Demenz.
Folgen für Therapieentwicklung und Forschung
Wenn Alzheimer tatsächlich eine Form der fehlgeleiteten Immunreaktion im zentralen Nervensystem beinhaltet, müssen therapeutische Strategien gezielt auf die spezifischen Immunwege im Gehirn ausgerichtet werden. Allgemeine Immunsuppression ist riskant und oft ineffektiv; stattdessen sind präzise Interventionen erforderlich, die neuroinflammatorische Signalwege modulieren, ohne die notwendige antimikrobielle Verteidigung zu kompromittieren.
Zu den vielversprechenden Ansätzen gehören:
- Modulation der Mikroglia: Mikroglia sind die residenten Immunzellen des Gehirns und spielen eine entscheidende Rolle in Synapsenremodellierung, Abfallbeseitigung und Entzündungssteuerung. Zielgerichtete Therapien könnten Mikroglia in einen schützenden, reparativen Zustand überführen (sog. M2-ähnliche Phänotypen) oder pathologische Aktivierungsmuster unterdrücken.
- Selektive Neuroinflammation-Blocker: Kleine Moleküle oder biologisch hergestellte Wirkstoffe, die gezielt entzündungsfördernde Signalwege blockieren und gleichzeitig die Überwindung der Blut-Hirn-Schranke berücksichtigen, sind ein zentrales Forschungsziel. Wirkstoffe, die IL-1ß-, TNF- oder NLRP3-Inflammasom-Signalwege modulieren, werden intensiv untersucht.
- Feinregulierung von Beta-Amyloid-Dynamiken: Anstatt Beta-Amyloid vollständig zu entfernen, könnten Therapien darauf abzielen, seine physiologische, antimikrobielle Funktion zu erhalten und gleichzeitig pathologische Aggregationsprozesse und entzündliche Rückkopplungen zu unterbrechen. Dies erfordert Biomarker, die zwischen schützenden und schädlichen Amyloid-Reaktionen unterscheiden können.
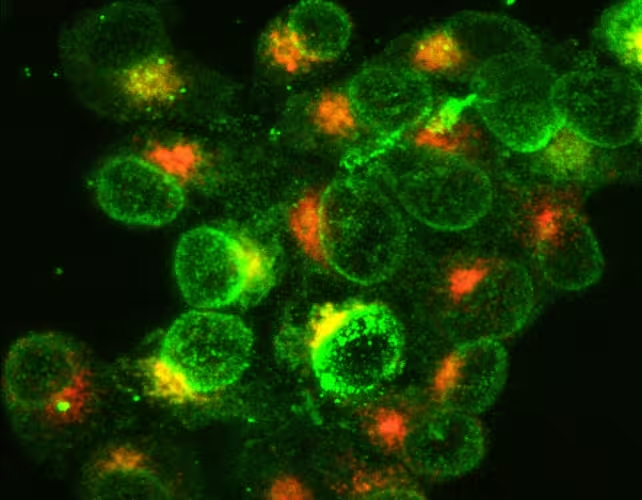
Weiße Blutkörperchen des Immunsystems, aktiviert zur Bekämpfung einer bakteriellen Infektion. Grün zeigt die Expression von Molekülen auf ihrer Oberfläche, Orange die Synthese von Molekülen im Inneren der Zellen.
Die öffentliche Gesundheitsdimension ist enorm: Weltweit leben mehr als 50 Millionen Menschen mit Demenz, und alle paar Sekunden kommt eine neue Diagnose hinzu. Neben dem persönlichen Leid für Betroffene und Angehörige stellt Alzheimer eine massive wirtschaftliche Belastung für Gesundheitssysteme, Pflegesektoren und Sozialdienste dar. Daraus ergibt sich die dringende Notwendigkeit für innovative, mechanistisch fundierte Lösungen, die Prävention, frühzeitige Diagnose und personalisierte Therapien verbinden.
Forschungsprioritäten und Zukunftsaussichten
Um substanzielle Fortschritte zu erzielen, sind intensive interdisziplinäre Kooperationen nötig. Neurologie, Immunologie, Infektionsmedizin, Alterungsforschung, Molekularbiologie und bioanorganische Chemie müssen zusammengeführt werden. Wichtige Schwerpunkte für die kommenden Jahre umfassen:
- Langfristige Kohortenstudien: Gut charakterisierte, prospektive Kohorten mit umfassenden klinischen, molekularen und bildgebenden Daten sind notwendig, um kausale Zusammenhänge zu identifizieren, Risikomarker zu validieren und verschiedenartige Pathways zu differenzieren.
- Verbesserte bildgebende Marker: Tracer, die neuroinflammatorische Prozesse, Mikroglia-Aktivierung oder pathologische Aggregationsformen direkt sichtbar machen und die Blut-Hirn-Schranke passieren, würden die Diagnostik und die Überwachung therapeutischer Effekte revolutionieren.
- Biomarker zur Differenzierung von Reaktionen: Es werden dringend Biomarker benötigt, die zwischen antimikrobiellen Reaktionen, alterungsbedingter Immunaktivierung und autoimmunen Prozessen unterscheiden können. Solche Marker erleichtern präzisionsmedizinische Entscheidungen und zielgerichtete Studien.
- Interventionstrials mit neuroimmunologischer Zielsetzung: Klinische Studien, die direkt Neuroimmunpfade manipulieren — etwa durch Mikroglia-Modulatoren, selektive Inflammasom-Inhibitoren oder Medikamente, die den Metallstoffwechsel im Gehirn regulieren — sind Priorität, um Wirkmechanismen und klinischen Nutzen zu prüfen.
Ob Alzheimer letztlich überwiegend autoimmune, infektiöse, metabolische oder multifaktorielle Ursachen hat, bleibt eine offene Frage. Die Umorientierung der Forschung hin zu einer immunzentrierten Sichtweise eröffnet jedoch neue diagnostische und therapeutische Wege, die bislang wenig beachtet wurden. Dies umfasst auch Präventionsstrategien: Verbesserung der oralen Gesundheit, Kontrolle chronischer Infektionen, Management vaskulärer Risikofaktoren, Ernährungsinterventionen und Lebensstilmaßnahmen könnten das Gesamtrisiko beeinflussen und sind Gegenstand intensiver Untersuchungen.

Fazit
Die Betrachtung von Alzheimer durch ein immunzentriertes Prisma verändert etablierte Annahmen und richtet die Aufmerksamkeit auf bislang vernachlässigte Zielstrukturen. Ein tieferes Verständnis darüber, wie Beta-Amyloid, Mikroglia, Mitochondrien, Pathogene und Metallhomöostase im alternden Gehirn interagieren, ist entscheidend, um wirksame Präventions- und Behandlungsstrategien zu entwickeln. Nur durch koordinierte, multidisziplinäre Forschung, neue Biomarker und gezielte therapeutische Konzepte lassen sich die globale Herausforderung und die humanitäre Krise, die Alzheimer darstellt, langfristig wirksam adressieren.
Quelle: sciencealert

Kommentar hinterlassen