8 Minuten
Wissenschaftler haben eine neuartige Nanopartikelbehandlung eingesetzt, um einen wichtigen Transportweg an der Blut‑Hirn‑Schranke (BHS) bei Mäusen wiederherzustellen. Dadurch konnten toxische Amyloid‑Beta‑Ablagerungen, die mit der Alzheimer‑Krankheit in Verbindung gebracht werden, innerhalb weniger Stunden entfernt werden. Nach drei Injektionen verhielten sich zuvor kognitiv beeinträchtigte Tiere wie gesunde Kontrollen, und die positiven Effekte hielten über Monate an.
Das Tor reparieren statt daran vorbeizuschleichen
Jahrzehntelang betrachteten Forscher die Blut‑Hirn‑Schranke als ein Problem, das es zu umgehen gilt: eine dichte Zellbarriere, die viele Medikamente vom Gehirn fernhält. Zahlreiche Teams versuchten, Wirkstoffe in Nanopartikeln zu tarnen oder die Barriere kurzzeitig mit fokussiertem Ultraschall zu öffnen, um Therapien hindurchzulassen. Die internationale Kooperation unter Leitung des Institute for Bioengineering of Catalonia (IBEC) und des West China Hospital Sichuan University (WCHSU) stellt diese Sichtweise auf den Kopf: Möglicherweise ist die BHS bei Alzheimer selbst gestört, und die Reparatur ihrer Transportmechanismen könnte dem Gehirn erlauben, toxische Abfallstoffe wieder auszuscheiden.
Diese Perspektive verschiebt den Fokus von reiner Wirkstoffzustellung hin zu vaskulärer Reparatur und Clearance‑Mechanismen. Statt nur zu versuchen, Medikamente an die neuralen Aggregate heranzubringen, wird hier die Idee verfolgt, die physiologische Funktion der Blutgefäße und ihrer Transportrezeptoren wiederherzustellen. Damit eröffnet sich ein neues Feld in der Alzheimer‑Forschung, das Schlagworte wie Blut‑Hirn‑Schranke, vaskuläre Gesundheit und LRP1‑vermittelte Clearance in den Mittelpunkt rückt.
Wie das Experiment funktionierte
Die Forschenden entwickelten Nanopartikel, die nicht nur als Träger dienen, sondern aktiv das zelluläre Verhalten an der BHS verändern. Zielmolekül war das endotheliale LRP1 (low‑density lipoprotein receptor‑related protein 1), ein auf der blutseitigen Seite der Gehirngefäße exprimierter Rezeptor, der an der Vermittlung des Transports von Amyloid‑Beta aus dem Gehirn beteiligt ist. In genetisch veränderten Mausmodellen mit Alzheimer‑ähnlicher Genetik führten drei Injektionen der Nanopartikel zu einer Kaskade molekularer Ereignisse, die diesen Clearance‑Weg wiederherstellten.
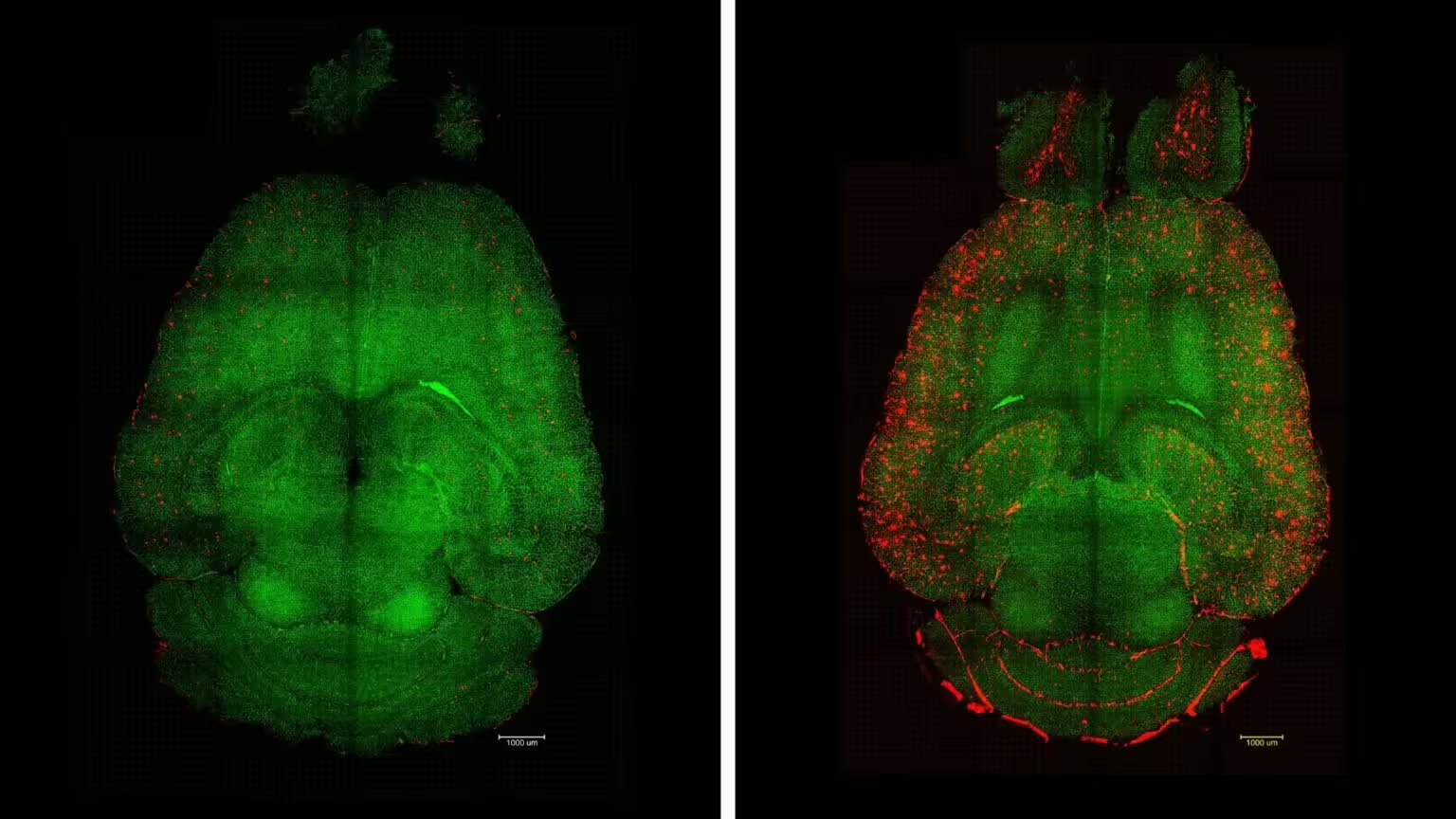
Amyloid‑Beta‑Plaques (rot) wurden aus den Gehirnen behandelter Mäuse (links) entfernt, während unbehandelte Kontrollen (rechts) weiterhin Plaques zeigten. Gefäße der Blut‑Hirn‑Schranke sind in Grün dargestellt. (IBEC)
Bereits wenige Stunden nach der ersten Verabreichung ging die Plaque‑Last um nahezu 45 Prozent zurück. Nach Abschluss der gesamten Behandlung zeigten die Tiere Lern‑ und Gedächtnisleistungen im Raumgedächtnis, die mit denen gesunder Vergleichstiere vergleichbar waren. Bemerkenswert ist, dass diese kognitiven Verbesserungen mindestens sechs Monate anhielten, was für eine dauerhafte Wiederherstellung der Clearance‑Funktion spricht und nicht nur für eine kurzfristige Symptombehebung.
Mechanistisch scheinen die Nanopartikel die Aktivität von LRP1 zu modulieren und damit den vesikulären Transport von Amyloid‑Beta über das Endothel in das Blut zu re‑aktivieren. Zusätzlich beobachteten die Forscher Veränderungen in Signalwegen, die mit Endozytose, Transzytose und Gefäßstabilität zusammenhängen. Solche Effekte deuten darauf hin, dass die Partikel als „aktive Ingenieure“ wirken und nicht lediglich als passive Wirkstoffträger.
Warum das wichtig ist: Fokus auf vaskuläre Reparatur
Die meisten derzeitigen Alzheimer‑Medikamente zielen darauf ab, Plaques und Tau‑Tangles im Gehirn zu entfernen oder zu neutralisieren. Substanzen wie lecanemab und donanemab zeigen zwar eine gewisse Verlangsamung des Krankheitsverlaufs, können die Erkrankung aber nicht rückgängig machen. Das IBEC‑WCHSU‑Team argumentiert, dass die ausschließliche Konzentration auf intraneurale Aggregate die Grenzen des Gehirns übersieht — jene Bereiche, in denen gestörter Transport und vaskuläre Dysfunktion die Neurodegeneration auslösen oder beschleunigen könnten.
"Die therapeutischen Implikationen sind tiefgreifend", schreiben die Forschenden und schlagen vor, dass die Wiederherstellung des Verkehrs über die BHS es dem Gehirn erlauben könnte, nicht nur Amyloid‑Beta, sondern ein breites Spektrum toxischer Moleküle auszuleiten. "Wir vermuten, dass es wie eine Kaskade wirkt: Wenn toxische Spezies wie Amyloid‑Beta akkumulieren, schreitet die Krankheit voran. Sobald jedoch das Gefäßsystem wieder funktionstüchtig ist, beginnt es, Amyloid‑Beta und andere schädliche Moleküle zu entfernen, wodurch das gesamte System sein Gleichgewicht zurückgewinnen kann", erklärt Giuseppe Battaglia, Bioingenieur am IBEC.
Diese Sichtweise verankert die Bedeutung von Gefäßgesundheit, Endothelfunktion und Rezeptor‑vermittelter Clearance in der Pathogenese der Alzheimer‑Krankheit. Schlüsselbegriffe für die weitere Forschung sind hier LRP1, vaskuläre Reparatur, Transzytose und neurovaskuläre Verbindung.
Experimentelle Details und Einschränkungen
Die berichteten Effekte stammen aus präklinischen Mausstudien, die auf eine spezifische, demenzrelevante Genvariante abzielten. In diesem Ansatz fungieren Nanopartikel als aktive Agens oder "kleine Ingenieure" auf molekularer Ebene, indem sie Rezeptoraktivität und Zell‑Signalwege modulieren, um die Entfernung von Amyloid über die BHS wieder zu ermöglichen. Die Forschenden nutzten histologische Analysen, immunfluoreszente Markierungen, biochemische Quantifizierungen sowie verhaltensbezogene Tests (zum Beispiel Labyrinthe und räumliche Lernaufgaben) zur Messung von Plaquerückgang und Gedächtniswiederherstellung.
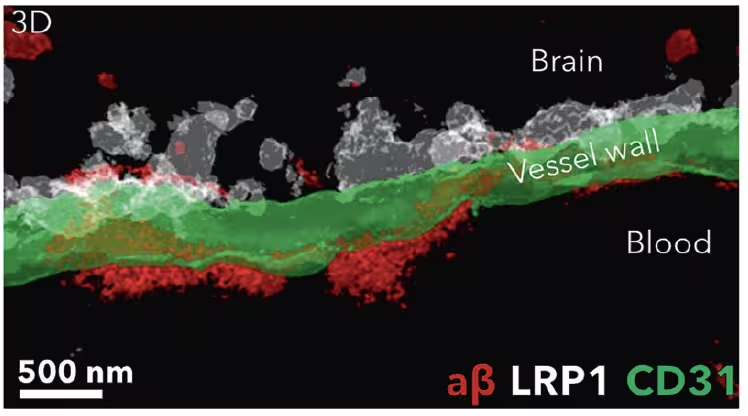
Nach Behandlung mit Nanopartikeln (weiß) wurden Amyloid‑Beta‑Ablagerungen (rot) von der Hirnseite der Blut‑Hirn‑Schranke (grün) entfernt und im Blut nachgewiesen. (Chen et al., STTT, 2025)
Dennoch ist Vorsicht geboten. Maus‑ und Menschenhirn unterscheiden sich in der vaskulären Architektur, der Dichte von Rezeptoren wie LRP1 und in den immunologischen Reaktionen. Unabhängige Experten betonen, dass der Erfolg in Nagetieren ein ermutigender, aber kein Garant für die klinische Wirksamkeit beim Menschen ist. Die Studie untersuchte nur eine begrenzte Anzahl von Tieren und fokussierte auf einen engen Subtyp der Erkrankung; breitere Tests sind erforderlich, um Sicherheit, Dosierung und die Frage zu klären, ob ähnliche Transportwege in gealterten menschlichen Gehirnen wiederherstellbar sind.
Zudem bleiben wichtige technische Fragen offen: Wie stabil sind die Nanopartikel im Blutkreislauf? Gibt es Off‑target‑Effekte an anderen Organen? Verursachen wiederholte Behandlungen Immunantworten oder Toxizitäten? Solche Sicherheitsaspekte sind entscheidend für die Translation in klinische Studien und verlangen umfangreiche toxikologische Evaluierungen.
Mögliche Folgen für Alzheimer‑Therapien
Die Reparatur des BHS‑Transports könnte bestehende Therapien ergänzen, statt sie zu ersetzen. Wenn die vaskuläre Funktion wiederhergestellt ist, könnten andere Behandlungen — monoklonale Antikörper, niedermolekulare Wirkstoffe oder auch Lebensstilinterventionen — effektiver werden, weil das Gehirn wieder in der Lage ist, Abbauprodukte aktiv auszuleiten. Das Konzept erweitert auch den Zielraum für Wirkstoffentwickler: Statt nur Moleküle zu entwerfen, die die BHS überwinden, könnten Agents entwickelt werden, die die körpereigenen Clearance‑Systeme reaktivieren.
Aus pharmazeutischer Sicht würde eine solche Strategie neue Entwicklungswege eröffnen. Beispiele sind:
- Entwicklung von Nanoplattformen, die gezielt Endothelzellen modulieren
- Design von Wirkstoffen, die LRP1‑Signalwege stärken oder stabilisieren
- Kombinationstherapien, die vaskuläre Reparatur mit Plaque‑beseitigung verknüpfen
Dies würde die Pipeline für Alzheimer‑Medikamente diversifizieren und könnte die Erfolgswahrscheinlichkeit von klinischen Studien erhöhen, wenn die kombinierte Wirkung auf Clearance und neuronale Amyloid‑Reduktion synergistisch ist.
Expertenmeinung
Dr. Laura Mendes, Neurowissenschaftlerin mit Schwerpunkt neurovaskuläre Biologie am Global Brain Institute, kommentiert: "Dieses Paper setzt das Problem in einen neuen Rahmen. Anstatt Medikamente durch ein defektes Tor zu schleusen, schlägt es vor, die 'Rohrleitungen' zu reparieren — also die Mechanismen, die das Gehirn normalerweise sauber halten. Die Übertragung auf den Menschen wird herausfordernd sein, aber die Idee, endogene Clearance‑Wege wiederherzustellen, ist spannend und stimmt mit zunehmenden Belegen überein, dass vaskuläre Gesundheit zentral für das Demenzrisiko ist."
Julia Dudley von Alzheimer’s Research UK, die nicht an der Studie beteiligt war, äußerte vorsichtigen Optimismus: Die Ergebnisse "fügen der wachsenden Evidenz hinzu, dass die Reparatur der Blut‑Hirn‑Schranke selbst einen neuen Weg zur Behandlung von Alzheimer eröffnen könnte", bemerkte sie, und verwies gleichzeitig auf die Lücke zwischen Mausmodellen und menschlicher Erkrankung.
Weitere Stimmen aus der wissenschaftlichen Gemeinschaft fordern zudem unabhängige Replikationen und eine detaillierte Offenlegung der Nanopartikelzusammensetzung, damit toxikologische Bewertungen und Herstellbarkeitsanalysen möglich werden. Offenheit in der Methodik wird entscheidend sein, um Vertrauen und Validierung in unterschiedlichen Laboren zu ermöglichen.
Was kommt als Nächstes?
Das Team plant zusätzliche präklinische Arbeiten, um Langzeitsicherheit, Dosisbereiche und Wirksamkeit in unterschiedlichen Tiermodellen zu bewerten. Parallel notwendige Forschungsarbeiten sollen klären, ob ähnliche LRP1‑zentrierte Wege beim Menschen sicher moduliert werden können und ob Nanopartikelplattformen unter klinischen Qualitätsstandards (GMP) skaliert und hergestellt werden können.
Zentrale Fragestellungen für die kommenden Schritte sind:
- Reproduzierbarkeit: Können unabhängige Gruppen die Ergebnisse in anderen Mauslinien und größeren Kohorten bestätigen?
- Sicherheit: Welche Nebenwirkungen treten bei wiederholter Verabreichung auf, und wie reagieren gerontologische Modelle mit komorbiden Erkrankungen?
- Translation: Lassen sich die Nanopartikel und deren Wirkmechanismen in nicht‑menschliche Primaten oder in ex vivo‑Modellen mit menschlichen Endothelzellen nachweisen?
- Regulatorik und Herstellung: Sind die Materialien und Herstellungsprozesse für klinische Studien und späteren Einsatz skalierbar und regulierungskonform?
Wenn diese Ansätze repliziert und erweitert werden, könnte die Strategie der vaskulären Reparatur eine neue Angriffsrichtung gegen die Alzheimer‑Krankheit eröffnen: eine, die die körpereigenen Clearance‑Systeme des Gehirns nutzt, anstatt sich ausschließlich auf externe Wirkstoffe zu verlassen. Damit könnte sich das therapeutische Paradigma verschieben — weg von alleiniger Plaquereduktion hin zu einer ganzheitlicheren Wiederherstellung der neurovaskulären Homöostase.
Zum Schluss bleibt festzuhalten, dass die vorliegenden Daten einen vielversprechenden Präzedenzfall schaffen, jedoch noch zahlreiche Schritte bis zur klinischen Anwendung erforderlich sind. Interdisziplinäre Kooperationen zwischen Neurobiologen, Bioingenieuren, Toxikologen, Klinikern und Regulierungsbehörden werden entscheidend sein, damit aus dieser experimentellen Idee ein sicherer und wirksamer Therapieansatz für Menschen mit Alzheimer‑Krankheit werden kann.
Quelle: sciencealert

Kommentar hinterlassen