9 Minuten
Neurowissenschaftler beschreiben das menschliche Gehirn heute nicht mehr als eine starre Maschine, sondern als ein Organ, dessen Verschaltungen sich im Laufe des Lebens in vorhersehbaren Phasen verändern. Eine neue groß angelegte MRT-Studie, die von der frühen Kindheit bis in das neunte Lebensjahrzehnt reicht, identifiziert vier bedeutende Wendepunkte, die das Leben in fünf verschiedene neurologische Epochen gliedern — jede mit ihrem eigenen Muster von Wachstum, Konsolidierung oder Rückgang.
Lebenslange Kartierung neuronaler Vernetzung
Ein Forscherteam der University of Cambridge und der University of Pittsburgh analysierte MRT-Aufnahmen von 3.802 neurotypischen Teilnehmenden im Alter von der Säuglingszeit bis 90 Jahren. Indem sie nachverfolgten, wie sich die strukturelle Konnektivität mit dem Alter verändert, identifizierten die Forschenden konsistente Wendepunkte bei etwa 9, 32, 66 und 83 Jahren. Diese Zeitpunkte trennen fünf breite Phasen, die die Autorinnen und Autoren als Kindheit, Adoleszenz, Erwachsenenalter, frühe Alterung und späte Alterung bezeichnen.
Diese Wendepunkte sind nicht willkürlich. Sie spiegeln messbare Verschiebungen in zwei komplementären Aspekten der Gehirnarchitektur wider: zum einen, wie dicht Regionen miteinander vernetzt sind (Netzwerkdichte), und zum anderen, wie effizient Informationen zwischen ihnen fließen (globale und lokale Effizienz). Vereinfacht gesagt wandelt sich die Vernetzung des Gehirns von einem dicht vernetzten — aber weniger organisiertem — Netzwerk in der frühen Kindheit zu einer spärlicheren, effizienteren und stärker spezialisierten Topologie im mittleren Lebensalter, bevor in den späteren Jahrzehnten eine progressive Desintegration einsetzt.
Die fünf Epochen der Hirn‑Vernetzung
Epoche 1 — Geburt bis ~9 Jahre: Rasches Wachstum, danach Beschneidung
Die erste Epoche ist gekennzeichnet durch eine dramatische Expansion. In der Säuglings- und frühen Kindheitsphase wachsen sowohl die graue Substanz (Zellkörper der Neurone) als auch die weiße Substanz (Axone und ihre Myelinscheiden) schnell. Diese Phase legt eine Fülle von Synapsen und Verbindungswegen an und verleiht jungen Gehirnen eine enorme Neuroplastizität — die Fähigkeit, zu lernen und sich umzustrukturieren.
Je näher Kinder der Pubertät kommen, desto stärker beginnt diese üppige Verschaltung verfeinert zu werden. Neuronales Pruning entfernt redundante oder schwache Verbindungen und hinterlässt ein schlankeres, effizienteres Netzwerk. Forschende beschreiben dieses frühe Muster als Übergang von einem dichten, diffusen Netzwerk hin zu stärker optimierten und spezialisierten Schaltkreisen. Diese Prozesse sind eng verknüpft mit Entwicklungen in Sprache, sensorischer Verarbeitung und Grundfertigkeiten des Lernens.
Epoche 2 — Adoleszenz: Verfeinerung und steigende Effizienz
Die Adoleszenz bringt eine weitere Welle struktureller Reorganisation mit sich. Hormonelle Veränderungen der Pubertät fallen mit einem anhaltenden Ausbau des Volumens der weißen Substanz und einer stärkeren Aufteilung funktionaler Systeme zusammen. Kenngrößen wie die globale Effizienz — also wie gut verschiedene Regionen über das gesamte Gehirn kommunizieren — und die lokale Effizienz verbessern sich in dieser Phase deutlich.
Diese strukturellen Veränderungen unterstützen Fortschritte in exekutiven Funktionen, Informationsverarbeitung und sozial-emotionalen Fähigkeiten. Zugleich ist die Adoleszenz eine sensible Phase: Weil das Gehirn aktiv umstrukturiert wird, ist es besonders lernfähig, aber gleichzeitig anfälliger für negative Umwelteinflüsse, Stress oder neuropsychiatrische Risiken.
Epoche 3 — Stabilisierung im frühen Erwachsenenalter (um 32)
Entgegen der weit verbreiteten Annahme, das Gehirn sei Mitte 20 voll entwickelt, deutet die neue Analyse auf einen späteren Meilenstein hin. Etwa mit 32 Jahren verlangsamt sich die bisherige Trajektorie struktureller Veränderungen: großskalige, richtungsweisende Umbauten werden weniger ausgeprägt und die Gesamtarchitektur stabilisiert sich. Dieses Alter korrespondiert auch mit anderen Studien, die Plateaus in bestimmten kognitiven Eigenschaften wie Intelligenzkomponenten oder Persönlichkeitsmerkmalen beobachten.
Während dieses jahrzehntelangen Abschnitts werden neuronale Netzwerke modularer und stärker in funktionale Subnetzwerke gegliedert: Regionen arbeiten in spezialisierten Einheiten statt in weit verzweigten, überlappenden Netzen. Diese Spezialisierung trägt zu einer konsistenten und effizienten Leistungsfähigkeit in vielen kognitiven Domänen bei — etwa bei Entscheidungssprozessen, Problemlösen und stabiler Arbeitsgedächtnisfunktion.
Epoche 4 — Frühe Alterung (um 66): Erste Zeichen von Verschlechterung
Ab Mitte sechzig zeigen sich in den strukturellen Netzwerken die ersten klaren Anzeichen eines Rückgangs. Die Integrität der weißen Substanz und die Konnektivität zwischen Regionen nehmen ab, was zu spärlicheren Netzwerken und verringerter globaler Effizienz führt. Diese Reorganisation verläuft schrittweise, ist aber messbar: Die Kommunikation über weite Distanzen im Gehirn wird weniger zuverlässig, während lokale Schaltkreise oft noch funktionstüchtig bleiben.
Forschende führen diese Veränderungen auf normale Alterungsprozesse zurück, etwa auf Abbau von Myelin, vaskuläre Veränderungen und kumulative zelluläre Belastungen. Auf Populationsebene könnten diese Netzwerkverschiebungen subtilen Einbußen in Verarbeitungsgeschwindigkeit, Multitasking‑Fähigkeit und anderen Funktionen zugrunde liegen, die breite Koordination über das Gehirn erfordern.
Epoche 5 — Späte Alterung (um 83): Von globaler zu lokaler Belastung
In den frühen Achtzigern verschiebt sich die kognitive Last zunehmend von globaler Koordination hin zu lokaler Verarbeitung. Die globale Konnektivität nimmt weiter ab, sodass kleinere, isoliertere Netzwerke einen größeren Anteil der kognitiven Arbeit übernehmen müssen. Die Stichprobe für diese letzte Epoche war in der Studie kleiner als in jüngeren Altersgruppen, weshalb die Forschenden zu Vorsicht mahnen. Dennoch stimmt dieses Muster mit vielen klinischen Beobachtungen eines funktionellen Abfalls im hohen Alter überein.
Die Autorinnen und Autoren betonen, dass diese phasenbasierten Befunde auf Populationsebene kein individuelles Schicksal festschreiben. Stattdessen bieten sie einen Rahmen, um zu verstehen, wann das Gehirn für bestimmte Aufgaben besonders optimiert ist — oder wann es besonders verwundbar gegenüber Erkrankungen und Dysfunktionen sein könnte.
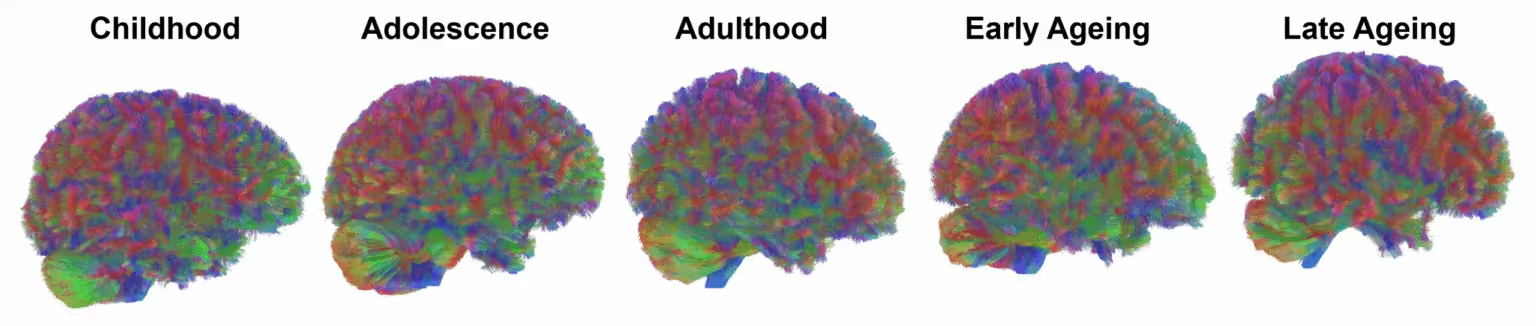
Die fünf Epochen der Hirn‑Alterung, wie sie Forschende identifiziert haben
Wie die Studie Veränderungen gemessen hat
Anstatt einzelne Regionen isoliert zu betrachten, analysierte das Team Ganz‑Gehirn‑Konnektivitätsnetzwerke. Sie quantifizierten Kennzahlen wie Netzwerkdichte, globale Effizienz, Modularität und lokale Effizienz, um abzubilden, wie sich die Topologie des Gehirns mit dem Alter verschiebt. Die Daten ergaben ein klares Muster: Frühes Leben begünstigt dichte, aber schwache Netzwerke; das Erwachsenenalter zeichnet sich durch sparsame, starke Verschaltungen aus; und das Alterungsprozess führt zu einer Reduktion der Gesamtvernetzung.
Die Visualisierungen der Studie veranschaulichen diese Veränderungen über Jahrzehnte hinweg. Separate Analysen zeigen ähnliche Verläufe bei Männern und Frauen, wobei Zeitpunkt und Ausmaß der Veränderungen variieren können. Die Autorinnen und Autoren verweisen zudem auf aktuelle Arbeiten, die nahelegen, dass spezifische Lebensereignisse — etwa die Menopause — eigene strukturelle Veränderungen auslösen können, die funktionale Folgen wie vorübergehende Beeinträchtigungen von Gedächtnis oder Aufmerksamkeit haben.
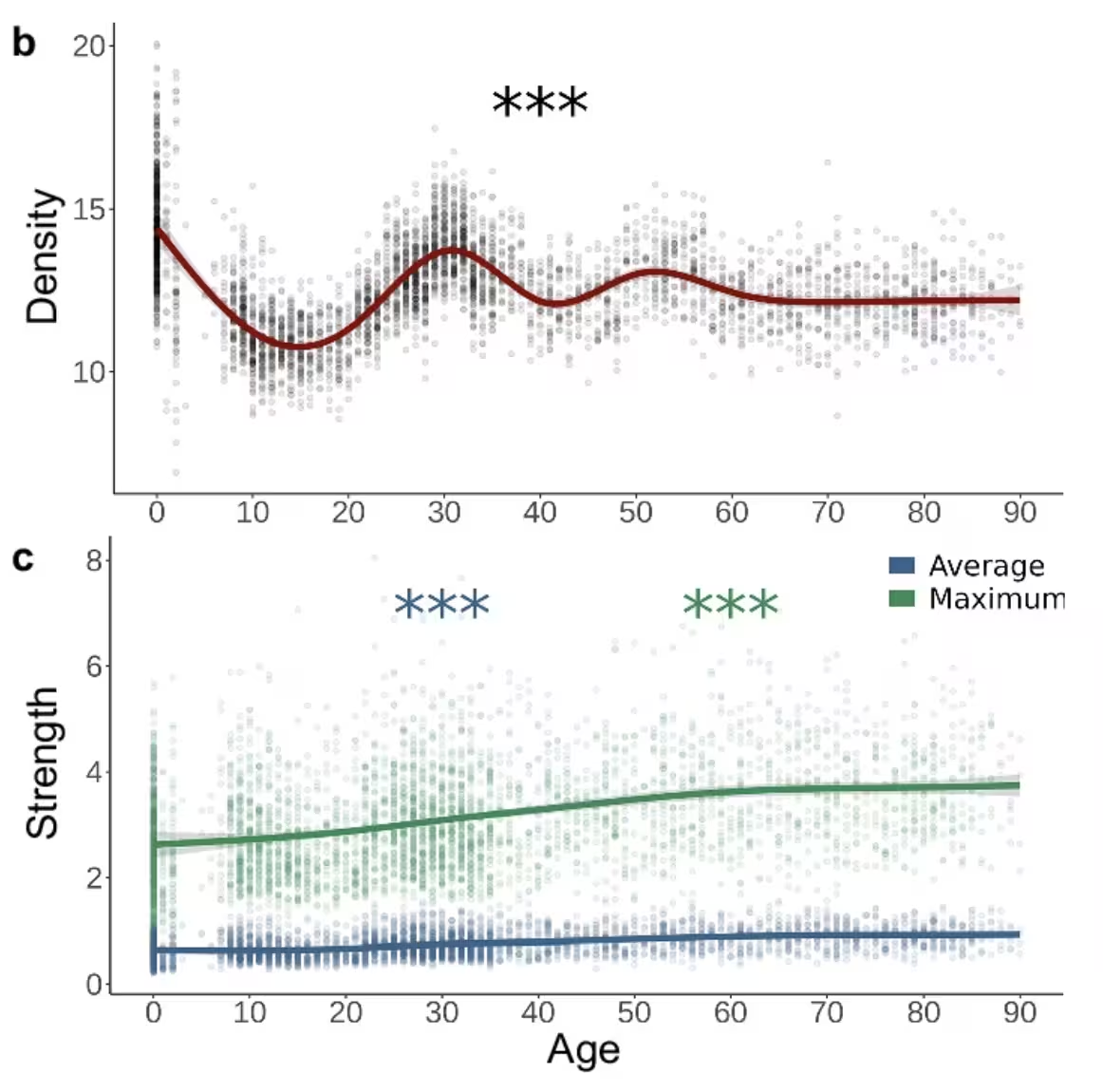
Veränderungen in der gesamten Netzwerk-Konnektivität über die Lebensspanne zeigen den üblichen Wechsel von dichten, schwächeren Netzwerken in der frühen Lebensphase zu spärlicheren, stärkeren Netzwerken im späteren Leben.
Warum das wichtig ist: Gesundheit, Lernen und gezielte Forschung
Die Einordnung von Gehirnveränderungen in Epochen schafft ein nützliches Gerüst für Klinikerinnen und Kliniker sowie für Pädagoginnen und Pädagogen. Wissen wir, wann das Gehirn besonders plastisch ist, lassen sich Interventionen für Lernschwierigkeiten in der Kindheit oder kognitives Training im mittleren Alter gezielter planen. Ebenso kann die Erkenntnis, zu welchen Zeitpunkten strukturelle Verwundbarkeit steigt, Screening‑Strategien für neurodegenerative Erkrankungen präzisieren.
Die Autorinnen und Autoren fordern gezielte longitudinale Studien, die Individuen über diese Wendepunkte hinweg begleiten, insbesondere mit dichterer Datenerhebung im höheren Alter. Solche Studien könnten klären, ob beobachtete strukturelle Verschiebungen funktionelle Folgen wie ein erhöhtes Demenzrisiko vorhersagen und in welchem Maße Lebensstilfaktoren oder medizinische Interventionen die Trajektorie beeinflussen können.
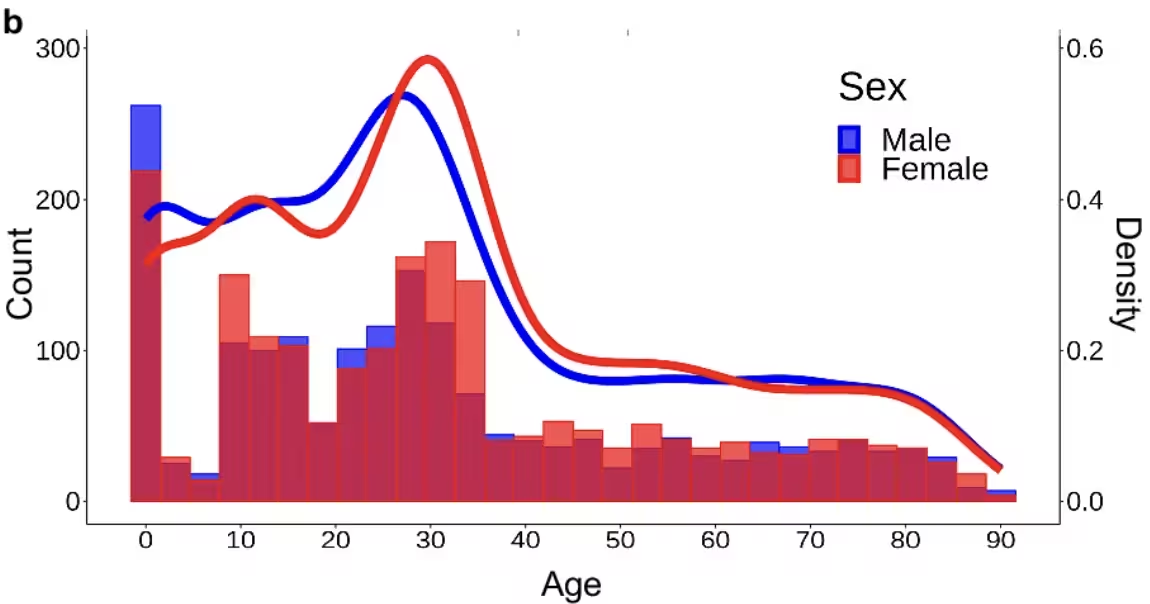
Netzwerkdichte des Gehirns nach Alter, aufgeschlüsselt nach Geschlecht
Fachliche Einschätzung
Dr. Maria Chen, eine kognitive Neurowissenschaftlerin, die nicht an der Studie beteiligt war, kommentierte: "Diese Arbeit ist kraftvoll, weil sie Tausende von Scans zu einer Lebenszeitkarte zusammenführt. Sie bestätigt, was viele kleinere Studien angedeutet haben — dass der Lebenszyklus des Gehirns durch markante Umstrukturierungen gegliedert ist. Für Klinik, Bildung und Gesundheitspolitik ist das Timing von Bedeutung: Interventionen wirken besser, wenn sie mit den natürlichen Fensterperioden des Gehirns übereinstimmen."
Implikationen und künftige Forschungsfelder
Über die Kartierung der großen Epochen hinaus wirft die Studie praktische Fragen auf: Wie verändern Genetik, Umwelt, Bildung und Gesundheitsverhalten die individuelle Trajektorie? Können Interventionen wie kognitives Training, das Management kardiovaskulärer Risikofaktoren oder zielgerichtete medikamentöse Therapien das früh einsetzende Altern der weißen Substanz verlangsamen? Die Autorinnen und Autoren sehen diese Fragen als logische nächste Schritte — mit dem epochenbasierten Rahmen als Grundlage für lebensphasenorientierte klinische Studien und Public‑Health‑Strategien.
Technisch betrachtet liefert die Studie auch methodische Impulse: die Kombination großer Multi‑Cohort‑Datensätze, harmonisierte MRT-Protokolle und fortgeschrittene Netzwerkanalysen (Graphentheorie, Modularitätsanalysen, Robustheitsprüfungen) eröffnet robuste Vergleiche über die Lebensspanne. Solche Ansätze erhöhen die Aussagekraft von Befunden zur strukturellen Konnektivität und erlauben es, Hypothesen zu testen, die von molekularen Mechanismen (z. B. Myelinmetabolismus) bis hin zu Verhaltensinterventionen reichen.
Letztlich reframt die Identifikation vorhersehbarer Lebensphasen der Hirnvernetzung Altern nicht als singulären Abstieg, sondern als dynamischen Prozess. Dieses Verständnis liefert Forscherteams präzisere Hypothesen darüber, wann und wie sie die Gehirngesundheit über Jahrzehnte hinweg fördern oder erhalten können — sei es durch Prävention, frühzeitige Diagnostik oder gezielte Therapien.
Wichtige Schlüsselbegriffe und Konzepte, die in der Debatte und Forschung weitergeführt werden sollten, umfassen Neuroplastizität, strukturelle Konnektivität, Netzwerkdichte, globale und lokale Effizienz, Modularität, weiße Substanzintegrität, Myelinschutz, vaskuläre Gesundheit, kognitive Reserve sowie lebensstilbezogene Schutzfaktoren wie Bewegung, kardiovaskuläre Fitness und soziale Teilhabe. Ein integrierter Forschungsansatz, der bildgebende Verfahren, genetische Daten und Lebensstilanamnesen kombiniert, dürfte entscheidend sein, um individuelle Verläufe besser vorhersagen und gezielt intervenieren zu können.
Quelle: sciencealert

Kommentar hinterlassen