8 Minuten
Forscher haben eine nichtinvasive MRT‑Technik entwickelt, die winzige, rhythmische Erweiterungen und Kontraktionen von Blutgefäßen im lebenden menschlichen Gehirn kartiert. Dieser Ansatz könnte aufzeigen, wie sich die mikrovaskuläre Pulsatilität mit dem Alter und mit vaskulären Risikofaktoren verändert — und ob solche Veränderungen frühe Zeichen für Demenz oder kognitiven Abbau sind.
Ein neues Fenster in die Mikrozirkulation des Gehirns
Arterielles Pulsieren wirkt wie eine subtile Pumpe innerhalb des Schädels: Es treibt Flüssigkeitsbewegungen an und unterstützt die Beseitigung von Stoffwechselabfällen. Bislang war es schwierig, zu beobachten, wie mikroskopische Arterien und Kapillaren beim Menschen pulsieren, weshalb Forscher auf grobe Messungen oder Tiermodelle angewiesen waren. Ein Team der University of Southern California (USC) arbeitete mit Siemens Healthcare US zusammen und kombinierte zwei fortgeschrittene MRT‑Methoden, um volumetrische Pulsatilität im gesamten zerebrovaskulären Baum zu erfassen — von großen Ästen bis hin zu den feinsten Verzweigungen.
Wie die Bildgebungstechnik funktioniert
Die neue Methode vereint vascular space occupancy (VASO) mit arterial spin labeling (ASL). Kurz gefasst: Beide Methoden ergänzen sich technisch, sodass sich Volumenänderungen und Flussphänomene besser trennen lassen. Im Zusammenspiel ermöglicht das hybride Protokoll eine räumlich umfangreiche, nichtinvasive Sicht auf dynamische Mikrovaskulatur im lebenden Gehirn.
VASO: Messung des Gefäßvolumens
VASO registriert subtile Änderungen im Volumen von Blutgefäßen, indem es misst, wie Blut die Signale des umliegenden Gewebes verdrängt. Diese Technik ist empfindlich gegenüber minimalen Erweiterungen und Kontraktionen, die mit jedem Herzschlag auftreten. Technisch nutzt VASO den Unterschied in der Magnetisierung zwischen intravaskulärem Blut und extravaskulärem Gewebe, um lokale Volumenfluktuationen zu quantifizieren. In der Praxis erfordert das präzise Timing der Inversionsechos und eine robuste Unterdrückung unerwünschter Gewebesignale, damit kleine volumetrische Veränderungen in grauer und weißer Substanz zuverlässig detektiert werden können.
ASL: Blutflussmessung ohne Kontrastmittel
ASL markiert einströmendes Blutwasser als endogenen Tracer und erlaubt so die Messung von Blutfluss ohne injizierte Kontrastmittel. Durch das zeitliche Markieren des arteriellen Bluts und die spätere Detektion kann ASL regionale perfusionelle Informationen liefern. In Kombination mit VASO hilft ASL, rein flussbedingte Effekte von echten volumetrischen Pulsatilitäts‑Signalen zu trennen. Methodisch reduziert die Kopplung von ASL und VASO die Verwechslungsgefahr zwischen Volumenänderungen und veränderten Flussraten, was besonders wichtig ist, wenn man mikrovaskuläre Pulsationen in tiefen Hirnregionen vermisst.
Dank dieses hybriden Ansatzes erhalten Forschende erstmals eine nichtinvasive, volumetrisch umfassende Darstellung mikrovaskulären Verhaltens im menschlichen Gehirn. Die Kombination verbessert die Sensitivität für Mikropulsationen und reduziert Artefakte, die bei Einzeltechniken häufiger auftreten. Darüber hinaus ist das Verfahren kompatibel mit klinischen Hochfeld‑MRT‑Systemen und lässt sich potenziell in Forschungsnetzwerken und größeren Kohortenstudien skalieren.
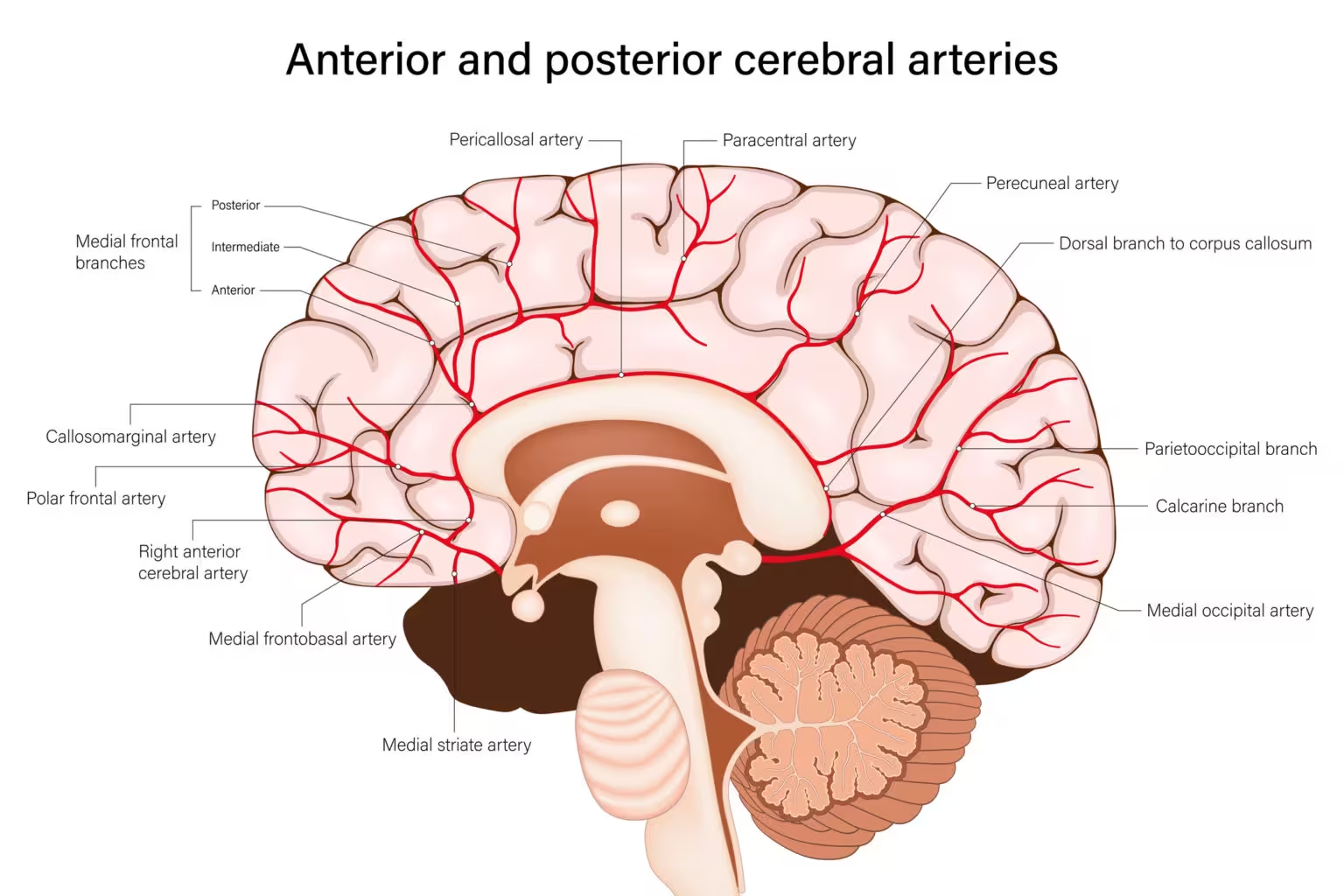
Hirnarterien
Beobachtungen der Studie
Mit dem kombinierten VASO–ASL‑Protokoll scannte das USC‑Team gesunde Freiwillige in zwei Altersgruppen — jüngere Teilnehmende (20er–30er) und ältere (mittlere 50er–60er). Dabei zeigte sich eine altersbedingte Zunahme der Pulsatilität in der tiefen weißen Substanz; dieser Effekt war bei älteren Probanden mit diagnostizierter Hypertonie stärker ausgeprägt. Solche Ergebnisse beim Menschen stehen im Einklang mit aktuellen Tierversuchen, die einen Zusammenhang zwischen erhöhter Gefäßpulsation der weißen Substanz, Alterungsprozessen und vaskulärer Kleinerkrankung nahelegen.
Der leitende Untersucher Danny Wang beschreibt die arterielle Pulsation als einen zentralen Mechanismus für die Bewegung der Liquorflüsse (cerebrospinal fluid, CSF) und für die Clearance von Abfallstoffen aus dem Hirngewebe. Co‑Autor Fanhua Guo ergänzt, dass das Erfassen volumetrischer Pulsatilität sowohl in grauer als auch in weißer Substanz eine fehlende Brücke zwischen großkalibriger Gefäßdarstellung und mikroskopisch sichtbaren Mikrogefäßschäden schlägt, wie sie bei Demenzerkrankungen beobachtet werden.
Methodisch umfasste die Studie eine sorgfältige Kontrolle potenzieller Störfaktoren: Herzfrequenz‑Normalisierung, Atemparameter und physiologische Rauschunterdrückung waren integrale Bestandteile der Bildanalysekette. Zusätzlich wurden segmentierte Hirnregionen genutzt, um lokal unterschiedliche Pulsationsmuster in kortikalen versus subkortikalen Arealen zu identifizieren. Die Analyse berücksichtigte auch strukturelle Marker wie Volumenverlust, weiße‑Substanz‑Hyperintensitäten (WMH) und Mikroinfarkte, sodass Zusammenhänge zwischen Pulsatilität und etablierten radiologischen Zeichen kleiner Gefäßerkrankungen geprüft werden konnten.
Warum das für die Demenzforschung relevant ist
Erhöhte arterielle Pulsation könnte ein Hinweis auf altersbedingten Verlust an Mikrovaskulardichte oder Verzweigungsgrad sein — eine strukturelle Degeneration, die kleinen Gefäßen weniger Fähigkeit gibt, jede Druckwelle zu absorbieren. Wenn die verbleibenden Gefäße das Pulstvolumen verstärken, um den Druck zu verteilen, kann sich diese veränderte Dynamik negativ auf die CSF‑Zirkulation auswirken und die Clearance von proteinösen Abfallprodukten verlangsamen. Solche Mechanismen werden seit langem mit der Pathophysiologie der Alzheimer‑Krankheit und anderer Demenzen in Verbindung gebracht, weil gestörte Clearancewege die Akkumulation von Amyloid‑β und anderen toxischen Proteinen begünstigen können.
Wichtig ist, dass frühere Zusammenhänge zwischen zerebrovaskulärer Pulsation und kognitivem Abbau überwiegend aus Tiermodellen oder indirekten humanen Messungen abgeleitet wurden. Die nichtinvasive VASO–ASL‑MRT bietet nun eine direkte Messmethode, um zu testen, ob mikrovaskuläre Pulsatilität Vorhersagekraft für zukünftige kognitive Beeinträchtigungen besitzt oder als früher Biomarker für die kleine Gefäßerkrankung (small vessel disease, SVD) dienen kann. Ein validiertes, früh einsetzendes Biomarker‑Tool würde die Demenzfrüherkennung, Risikostratifizierung und das Monitoring therapeutischer Interventionen erheblich verbessern.
Darüber hinaus eröffnet die Technik die Möglichkeit, Wechselwirkungen zwischen vaskulären Risikofaktoren (z. B. Bluthochdruck, Diabetes mellitus, Atherosklerose) und Pulsationsmustern direkt zu untersuchen. Solche Erkenntnisse könnten klinisch nutzbar sein: Ließen sich etwa Behandlungseffekte von Blutdrucktherapien, Lipidsenkern oder Lebensstilinterventionen anhand veränderter Mikropulsationen nachweisen, wäre das ein konkreter Ansatzpunkt zur Prävention vaskulär bedingter kognitiver Störungen.
Zukünftige Perspektiven und klinisches Potenzial
Die Methode eröffnet mehrere Forschungs‑ und Anwendungspfade: longitudinale Studien könnten Pulsatilitätsveränderungen über Jahre verfolgen; randomisierte klinische Studien könnten prüfen, ob Reduktion vaskulärer Risikofaktoren Pulsationsmuster normalisiert; und die Integration mit anderen Bildgebungs‑Biomarkern (etwa Amyloid‑PET, Tau‑PET, Diffusions‑MRT) würde eine multimodale Charakterisierung vaskulärer und neurodegenerativer Prozesse erlauben. Mit weiterer Validierung könnte die volumetrische Pulsatilitätskartierung zu einem Instrument für frühe Risikostratifizierung, zur Überwachung therapeutischer Wirkungen oder zur Verfeinerung unseres Verständnisses beitragen, wie vaskuläre Gesundheit mit Neurodegeneration verknüpft ist.
Auf technischer Ebene sind noch Optimierungen denkbar: die Anpassung an unterschiedliche Feldstärken, die Automatisierung der Bildverarbeitungspipelines und die Standardisierung von Messprotokollen über Scannerhersteller hinweg. Solche Schritte sind wichtig, um Reproduzierbarkeit und Vergleichbarkeit zwischen Studien und klinischen Zentren sicherzustellen. Ferner könnte die Kombination von VASO–ASL mit funktionellen Messungen (fMRT) neue Einsichten in die Beziehung zwischen mikrovaskulärer Dynamik und neuronaler Aktivität liefern.
Expert Insight
„Diese Bildgebungserweiterung ist spannend, weil sie uns endlich die mikrovaskuläre Choreografie zeigt, die vermutlich vielen altersbedingten Veränderungen im Gehirn zugrunde liegt“, sagt Dr. Maya Patel, eine fiktive neurovaskuläre Forscherin. „Wenn erhöhte Pulsatilität strukturelle Schäden oder kognitiven Abbau vorwegnimmt, könnten Klinikteams früher intervenieren — etwa durch strikteres Management von Bluthochdruck, Strategien zur Stärkung der vaskulären Resilienz oder durch gezielte Unterstützung der CSF‑Clearance‑Wege.“
Die USC‑Studie, veröffentlicht in Nature Cardiovascular Research, zeigt vielversprechende Resultate, wirft aber gleichermaßen neue Fragen auf: Warum nehmen Pulsationen speziell in der weißen Substanz zu? Wie interagieren individuelle Risikofaktoren wie Hypertonie, Diabetes oder Lebensstil mit Pulsatilitätsmustern? Zur Beantwortung dieser Fragen werden größere, diversere Kohorten und longitudinale Follow‑ups nötig sein. Nur so kann man robuste Schlussfolgerungen über Kausalität und klinische Relevanz ziehen.
Für die Gegenwart liefert der VASO–ASL‑Ansatz ein wichtiges Forschungsinstrument: ein skalierbares, nichtinvasives Fenster in die kleinsten Gefäße des Gehirns und ein potenzieller Frühanzeiger für vaskuläre Prozesse, die zur Demenz führen können. Ergänzend dazu sollte die Forschung unbedingt auf die Validierung von Referenzwerten, Test‑Retest‑Reliabilität und die Entwicklung klinischer Schwellenwerte zur Interpretation von Pulsatilitätssignalen zielen.
In der breiteren klinischen Anwendung könnten standardisierte Pulsatilitätskarten künftig in multidisziplinären Behandlungsentscheidungen einfließen — zum Beispiel bei der Abwägung von Therapien für Patienten mit kognitiven Beschwerden und vaskulären Risikofaktoren. In Kombination mit kardiovaskulären und metabolischen Parametern ließen sich individualisierte Managementpläne entwickeln, die gezielt vaskuläre Ursachen von kognitiven Störungen adressieren.
Zusammenfassend bietet die nichtinvasive Kombination aus VASO und ASL ein neues, technisch anspruchsvolles, aber praktikables Instrument, mit dem sich Fragen zur zerebralen Mikrozirkulation, zur CSF‑Dynamik und zur vaskulären Beteiligung an neurodegenerativen Erkrankungen direkt untersuchen lassen. Durch die Verbindung physikalischer Bildgebungsprinzipien mit klinischer Fragestellung nähert sich die Forschung der Möglichkeit, vaskuläre Biomarker in die Demenzdiagnostik und Prävention einzubeziehen — ein Schritt, der das Verständnis und die Behandlung vaskulärer Beiträge zu kognitiven Störungen substanziell voranbringen könnte.
Quelle: sciencealert

Kommentar hinterlassen