9 Minuten
Neue Forschungsergebnisse deuten darauf hin, dass eine Untergruppe der Gehirn-Immunzellen in einen schützenden Zustand wechseln kann, der typische Alzheimer-Pathologien bei Mäusen verlangsamt. Das Verständnis dieses Wechsels könnte neue Ansätze der Immuntherapie aufzeigen, mit denen sich die eigenen Abwehrzellen des Gehirns so lenken ließen, dass sie die Erkrankung bekämpfen.
Wenn Verteidiger zu Beschützern werden: Die überraschende Rolle der Mikroglia
Mikroglia sind die residenten Immunzellen des Gehirns: Sie räumen zelluläre Trümmer, schneiden Synapsen und reagieren auf Verletzungen. Bei Alzheimer zeigt sich ihr Verhalten bisweilen widersprüchlich — in einigen Situationen entfernen sie toxische Proteine, in anderen tragen sie durch anhaltende, schädliche Entzündungsreaktionen zur Neurodegeneration bei. Ein internationales Forscherteam unter Leitung der Neurowissenschaftlerin Pinar Ayata von der Icahn School of Medicine hat in Mausmodellen der Alzheimer-Krankheit untersucht, wie Mikroglia zwischen diesen gegensätzlichen Funktionszuständen wechseln.
Die Arbeitsgruppe nutzte detaillierte molekulare Profile und hochauflösende Bildgebung, darunter Einzelzell-Transcriptomics, räumliche Transkriptomik und immunhistochemische Verfahren, um die Heterogenität und Dynamik von Mikroglia in betroffenen Hirnregionen zu kartieren. Dabei zeigte sich, dass Mikroglia, die zu Ablagerungen von Amyloid-Beta-Proteinen (ein Kernmerkmal der Alzheimer-Pathologie) migrieren, in einen klar unterscheidbaren neuroprotektiven Zustand übergehen können. In dieser Konfiguration verlangsamen die Zellen sowohl die Akkumulation von Amyloid als auch die Aggregation des Tau-Proteins — die beiden toxischen Proteinprozesse, die am stärksten mit kognitivem Abbau und neuronaler Schädigung in Verbindung stehen.
Die Identifizierung dieses schützenden Mikroglia-Programms stützt sich auf mehrere orthogonale Messmethoden: Transkriptomdaten zeigen charakteristische Genexpressionsmuster, Imaging-Analysen dokumentieren morphologische Anpassungen und funktionelle Tests demonstrieren eine erhöhte Phagozytose von Amyloid-Plaques kombiniert mit einer gedämpften proinflammatorischen Zytokinproduktion. Solche multimodalen Befunde erhöhen die Wahrscheinlichkeit, dass das beschriebene Programm biologisch relevant und nicht nur ein Artefakt technischer Messungen ist.
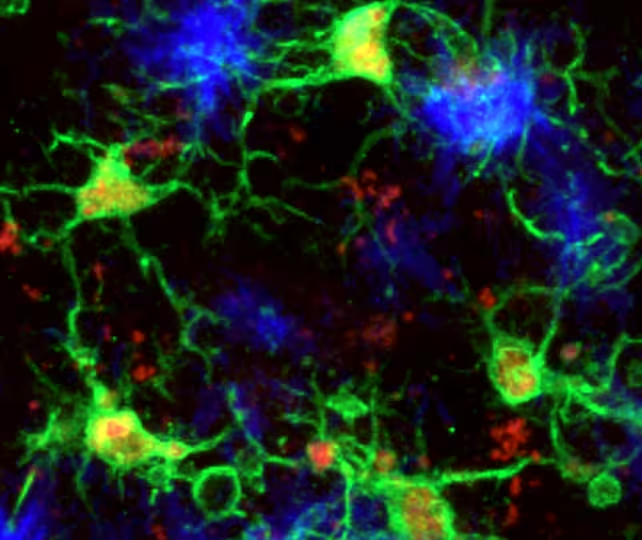
Mikroglia (grün) reagieren auf Amyloid-Beta-Plaques (blau) im Mausgehirn.
PU.1 und CD28: eine molekulare Signatur des Schutzes
Die schützenden Mikroglia teilen zwei entscheidende molekulare Merkmale: verringerte Mengen des Transkriptionsfaktors PU.1 und eine verstärkte Expression von CD28, einem Rezeptor, der normalerweise mit peripheren T‑Zellen des Immunsystems assoziiert wird. Diese Kombination scheint Mikroglia besser auszustatten, das Wachstum von Amyloid-Beta-Plaques zu begrenzen und die Tau-Aggregation in den gezeigten Mausexperimenten zu unterdrücken.
PU.1 (Spi1) ist ein Transkriptionsfaktor, der die Entwicklung und Identität von myeloiden Zellen reguliert. Eine Absenkung seiner Aktivität kann die Genprogramme verändern, die Entzündung und Phagozytose steuern. CD28 fungiert in T‑Zellen als kostimulatorischer Rezeptor und fördert Überleben, Proliferation und Zytokinproduktion; sein Auftreten auf Mikroglia ist unerwartet und weist auf eine Übertragung immunologischer Prinzipien vom peripheren System ins Gehirn hin. Die Forscher vermuten, dass CD28‑Signalgebung in Mikroglia eine spezielle, regulatorische Rolle einnimmt, die weniger proinflammatorisch ist und mehr auf Gewebehomöostase und Proteinentfernung abzielt.
Um Ursache und Wirkung zu prüfen, blockierte das Team gezielt die CD28-Produktion in Mausmodellen. Als Folge verschob sich das Mikroglia‑Profil zurück in einen entzündungsanfälligen Zustand, es bildeten sich mehr Amyloid-Plaques, und die schützende Phänotypik ging verloren. Solche genetischen Manipulationen stärken die These, dass das Gleichgewicht von CD28-Expression und PU.1-Aktivität mitentscheidet, ob Mikroglia als Wächter oder als Verstärker von pathologischer Neuroinflammation agieren.
Auch genetische Daten aus Humanstudien unterstützen diese Biologie: Personen mit natürlichen Varianten, die die PU.1‑Expression in bestimmten Gehirnzellen reduzieren, neigen dazu, später als der Durchschnitt Alzheimer zu entwickeln. Diese Korrelation liefert eine plausible molekulare Verbindung zwischen genetischer Variation und dem zeitlichen Auftreten der Erkrankung und lässt vermuten, dass PU.1‑modulierende Einflüsse das Krankheitsrisiko modulieren können.
Methodisch kombiniert die Studie sowohl experimentelle als auch genomische Evidenz: Mausmodelle erlauben kontrollierte Manipulationen (z. B. Knockout, RNA‑Interferenz oder CRISPR‑Gestützte Eingriffe), während Human‑Genetikanalysen (GWAS, eQTL‑Analysen) eine epidemiologische Einordnung erlauben. Zusammen ergeben diese Ansätze ein konsistentes Bild, das die Relevanz der gefundenen Signatur für Alzheimer‑Forschung und therapeutische Entwicklung erhöht.
Was das für Therapien und zukünftige Forschung bedeutet
Die Idee, Mikroglia in langlebige Beschützer zu verwandeln, ist verlockend und eröffnet neue Perspektiven für Alzheimer‑Therapien, bringt jedoch wichtige Vorbehalte mit sich. Alzheimer ist eine multifaktorielle Erkrankung: Genetik, Umweltfaktoren, vaskuläre Gesundheit, Stoffwechsel und Alterungsprozesse tragen in unterschiedlichem Maß zum Krankheitsverlauf bei. Eine erfolgreiche Behandlung wird daher vermutlich mehrere Ziele gleichzeitig ansprechen müssen.
- Immunmodulation: Die Entwicklung von Arzneimitteln oder Biologika, die CD28‑Signalwege in Mikroglia erhöhen oder PU.1 modulieren, könnte Zellen in den schützenden Zustand lenken. Dazu zählen small molecules, monoklonale Antikörper sowie gentechnische Ansätze.
- Sicherheit und Spezifität: Therapien müssen eine breite Immunaktivierung vermeiden, die die Neuroinflammation verschlimmern kann. Zielgerichtete Ansätze, die Mikroglia selektiv erreichen, sind essenziell, um unerwünschte systemische Effekte zu minimieren.
- Translation: Maus‑ und menschliche Mikroglia sind zwar ähnlich, aber nicht identisch. Die Bestätigung, dass das gleiche schützende Programm auch beim Menschen existiert, ist ein kritischer nächster Schritt — etwa durch Analyse von postmortalen Geweben, Einzelzell‑/Nukleus‑RNA‑Sequenzierung und iPSC‑abgeleiteten Mikroglia-Modellen.
Ergänzend zu diesen Punkten sollten Forschung und Entwicklung auch die technischen Herausforderungen berücksichtigen: die Überwindung der Blut‑Hirn‑Schranke für zielgerichtete Medikamentenabgabe, die Identifikation zuverlässiger Biomarker für eine sichere Patientenstratifizierung (z. B. PET‑Imaging für Amyloid und Tau, Liquor‑ und Blut‑Biomarker, zelltypenspezifische Expressionssignaturen) sowie Langzeitstudien zur Bewertung von Sicherheitsprofilen. Zudem gewinnen Kombinationstherapien an Bedeutung: eine Kombination aus Immunmodulation, Antikörpertherapien gegen Amyloid, Tau‑gerichteten Kleinstmolekülen und Maßnahmen zur Verbesserung vaskulärer sowie metabolischer Gesundheit könnte synergistische Effekte erzielen.
Fachleute, die in der Studie zitiert werden, betonen gleichzeitig das Potenzial und die Vorsicht. Anne Schaefer von der Icahn School of Medicine stellt fest, dass Mikroglia „nicht einfach nur destruktive Reaktionszellen bei Alzheimer sind — sie können zu Beschützern des Gehirns werden“, während die Genetikerin Alison Goate anmerkt, dass die Arbeit hilft zu erklären, warum niedrigere PU.1‑Spiegel mit einem geringeren Alzheimer‑Risiko verbunden sind. Der Epigenetiker Alexander Tarakhovsky von der Rockefeller University verknüpft den Befund mit einer breiteren Immunregulation und schlägt vor, dass die schützenden Mikroglia regulatorische Eigenschaften zeigen, die an regulatorische T‑Zellen in peripheren Geweben erinnern.
Langfristig stellen sich praktische Fragen für klinische Entwicklung: Wie lassen sich Mikroglia‑spezifische Signalwege pharmakologisch modulieren, ohne systemische Immunantworten zu aktivieren? Können Vektoren oder Nanopartikel so designt werden, dass sie selektiv Mikroglia erreichen? Lässt sich die CD28‑Signalgebung in Mikroglia durch Liganden oder agonistische Antikörper stimulieren, und ist eine temporäre oder permanente Modulation sinnvoller? Solche Fragen bestimmen die Prioritäten in präklinischen Programmen.
Expertise und weiterführende experimentelle Ansätze
Die Studie bietet mehrere experimentelle Ansatzpunkte, die andere Forscher aufgreifen können: gezielte Screening‑Plattformen zur Identifikation von kleinen Molekülen, die PU.1 modulieren; genetische Modellsysteme, die CD28 in Mikroglia spezifisch hoch- oder herunterregulieren; sowie funktionelle Assays, die Phagozytose, Zytokinsekretion und neuronale Überlebensraten quantifizieren. Darüber hinaus sind Langzeitstudien in alternativen Tiermodellen (z. B. nichtmenschliche Primaten) nützlich, um Unterschiede in Mikroglia‑Reaktionen zwischen Arten zu klären.
Ein weiterer Schwerpunkt sollte die Entwicklung sensitiver Biomarker sein, die den schützenden Mikroglia‑Zustand im vivo nachweisen können. Molekulare Bildgebung, Marker im Serum oder Liquor sowie zellfreie RNA‑Signaturen könnten helfen, patientenspezifische Therapien zu steuern und Therapieantworten zu überwachen. Schließlich ist die Integration von Genomik und funktioneller Neurowissenschaft unerlässlich, um Kausalzusammenhänge zwischen Genvarianten, zellulären Programmen und klinischem Verlauf zu etablieren.
Expert Insight
„Diese Studie fügt ein wichtiges Puzzlestück zur Alzheimer‑Forschung hinzu, indem sie zeigt, wie immunologische Identität im Gehirn vorteilhaft statt ausschließlich schädlich wirken kann“, sagt Dr. Maya Elfenbein, Neuroimmunologin und Wissenschaftskommunikatorin. „Die Herausforderung besteht nun in zweifacher Hinsicht: Erstens nachzuweisen, dass derselbe Mechanismus beim Menschen gilt, und zweitens präzise Methoden zu entwickeln, um Mikroglia in den schützenden Zustand zu überführen, ohne eine schädliche Entzündungsreaktion auszulösen.“
In die praktische Umsetzung übersetzt bedeutet das: Forscher und Pharmaunternehmen müssen sowohl die molekularen Hebel (z. B. CD28, PU.1) als auch die therapeutische Modalität (small molecules, Antikörper, Gen‑Therapien) gleichermaßen berücksichtigen. Parallel dazu bleibt die Validierung in menschlichem Gewebe und in klinischen Studien unerlässlich, bevor Aussagen zur Wirksamkeit und Sicherheit bei Menschen getroffen werden können.
Aus klinischer Sicht könnte ein erfolgreicher Ansatz, der Mikroglia reprogrammiert, die bestehenden Therapieoptionen ergänzen: Antikörper, die Amyloid direkt binden und entfernen, könnten in Kombination mit Mikroglia‑modulierenden Strategien effektiver sein, weil die körpereigene Entsorgungskapazität erhöht wird. Gleichzeitig wären Interventionen, die das vaskuläre System stärken und metabolische Risikofaktoren reduzieren, weiterhin wichtig, um das Gesamtumfeld für neuronale Erhaltung zu verbessern.
Während dieser mikrogliale Schutzmechanismus eine vielversprechende natürliche Barriere darstellt, betonen die Autoren, dass er allein wahrscheinlich nicht ausreicht, um den Krankheitsverlauf vollständig aufzuhalten. Sollte es jedoch möglich sein, Mikroglia beim Menschen in einen beständigen schützenden Zustand zu überführen, würde dies ein kraftvolles zusätzliches Instrumentarium in die Alzheimer‑Forschung und klinische Therapie einbringen.
Zusammenfassend eröffnet die Entdeckung eines CD28/PU.1‑assoziierten Schutzprogramms in Mikroglia neue Forschungs- und Therapieperspektiven für Alzheimer: von der Erforschung molekularer Mechanismen, über die Entwicklung gezielter Immunmodulatoren, bis hin zur Integration in multimodale Behandlungsstrategien, die auf Langzeitschutz des Gehirns abzielen. Die nächsten Jahre werden zeigen, ob diese Erkenntnisse vom Tiermodell in die klinische Anwendung übersetzbar sind und wie sie sich in bestehende Präventions- und Therapieansätze einfügen lassen.
Quelle: sciencealert

Kommentar hinterlassen