7 Minuten
Neuer neuronaler Schaltkreis verbindet Schlaf mit Körperreparatur
Im Schlaf fährt der Körper in einen Reparaturmodus: Wachstumshormon (GH) wird freigesetzt, um Muskeln und Knochen wiederaufzubauen und Stoffwechselprozesse zu regulieren. Bis vor Kurzem maßen Wissenschaftler GH in Blutproben, die über den Schlaf hinweg entnommen wurden, doch die neuronalen Schaltkreise, die diese Freisetzung auslösen und modulieren, blieben weitgehend unklar. Ein Team unter Leitung der University of California, Berkeley, hat nun neuronale Aktivität bei Mäusen über mehrere Schlaf-Wach-Zyklen kontinuierlich aufgezeichnet und einen Schaltkreis identifiziert, der die zeitliche Steuerung der Wachstumshormonfreisetzung in REM- und Non-REM-Schlafphasen unterscheidet.
Wissenschaftlicher Hintergrund und experimentelles Vorgehen
Das Team kombinierte kontinuierliche neuronale Aufzeichnungen in Mäusen mit detaillierten Hormonassays, um nachzuverfolgen, wie spezifische Neuronenpopulationen mit GH-Pulsen korrelieren. Zur Methodik gehörten Langzeit-Elektrophysiologie, optogenetische Manipulationen sowie paralelle Messungen von Blutspiegeln des Wachstumshormons. Forscher verfolgten Aktivitätsmuster in hypothalamischen Neuronen sowie in Alters- und Arousal-kontrollierenden Knotenpunkten des Hirnstamms. Diese multiplen Datenströme erlaubten es, feingliedrige zeitliche Zusammenhänge zwischen neuronaler Entladung und hormonellen Pulsen zu rekonstruieren.
Die Studie, veröffentlicht in Cell im Jahr 2025, baut auf langjährigen Beobachtungen auf, dass Schlafqualität und -architektur direkte Effekte auf endokrine Funktionen und die metabolische Gesundheit haben. Frühere Arbeiten zeigten, dass die Spitzen der GH-Freisetzung häufig mit bestimmten Schlafphasen verbunden sind, doch die zugrundeliegenden zellulären Mechanismen blieben spekulativ. Durch die Kombination von Verhaltens-EEG, Einzelzell- oder Populationsaufnahmen und zeitgleichen Hormondaten konnten die Autorinnen und Autoren erstmals Schaltkreislevel-Korrelationen mit hoher zeitlicher Auflösung nachweisen.
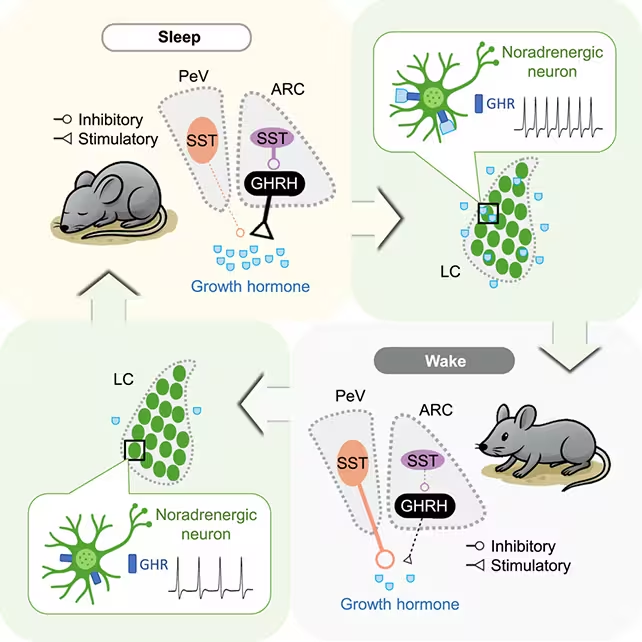
Die Forschenden analysierten die Freisetzung des Wachstumshormons bei Mäusen während Schlaf-/Wachzyklen.
Wesentliche technische Aspekte
- Kontinuierliche elektrophysiologische und optogenetische Aufzeichnungen ermöglichten eine präzise Synchronisierung zwischen neuronaler Feuerrate und GH-Pulsen, sodass Ursache-Wirkungs-Hypothesen geprüft werden konnten.
- Die Studie differenzierte Neuronen, die die GH-Freisetzung fördern, von solchen, die sie hemmen, und zeigte, dass sich deren relative Einflussnahme dynamisch zwischen Schlafstadien verschiebt.
- Besonders bedeutsam war die Beobachtung einer Rückkopplungsschleife mit dem Locus coeruleus, einem Kerngebiet des Hirnstamms, das für Wachheit zentral ist. Diese Verbindung legt nahe, dass arousale Zentren direkt in die zeitliche Steuerung endokriner Pulsation eingebunden sind.
Hauptergebnisse und physiologische Implikationen
Die Forschenden stellten fest, dass das Wachstumshormon sowohl im REM- als auch im Non-REM-Schlaf anstieg, die treibenden und hemmenden neuronalen Einflüsse auf diese Freisetzung jedoch je nach Schlafstadium ihre relative Wirksamkeit änderten. Während zum Beispiel bestimmte hypothalamische Populationen in Non-REM-Phasen stärker mit GH-Pulsen assoziiert waren, übernahmen in REM-Phasen andere Zelltypen oder Netzwerkkonstellationen eine dominante Rolle. Diese phasenabhängige Umschaltung deutet auf ein fein abgestimmtes Netzwerk hin, das Schlafarchitektur und hormonelle Rhythmen integriert.
Die Entdeckung einer reziproken Schleife mit dem Locus coeruleus spricht für ein eng balanciertes System: Schlaf begünstigt die GH-Sekretion, und GH wiederum kann Rückwirkungen entfalten, die Arousal und Wachheit modulieren. Das Gleichgewicht dieses Systems ist essenziell; wenn es durch chronischen Schlafmangel, fragmentierten Schlaf oder Schaltkreisdysfunktionen gestört wird, sind metabolische Folgen wahrscheinlich.
Wachstumshormon ist nicht nur für Wachstum und Gewebereparatur wichtig, sondern moduliert auch Glukose- und Lipidstoffwechsel. Unzureichende oder zeitlich misalignierte GH-Freisetzung, wie sie bei fragmentiertem oder qualitativ schlechtem Schlaf auftreten kann, korreliert epidemiologisch mit erhöhtem Risiko für Adipositas, Insulinresistenz, Typ-2-Diabetes und kardiovaskuläre Erkrankungen. Die neuen Erkenntnisse auf Schaltkreisniveau verknüpfen somit fundamentale Schlafneurobiologie mit endokriner Regulation und langfristiger Gesundheit und liefern eine mechanistische Brücke zwischen Laborbefunden und klinischen Beobachtungen.
Potenzielle klinische und Forschungsanwendungen
Das Verständnis der neuronalen Schaltkreise, die die zeitliche Steuerung der GH-Freisetzung übernehmen, eröffnet neue therapeutische Perspektiven. Zielgerichtete Pharmakologie oder neuromodulatorische Interventionen könnten dazu dienen, normale GH-Rhythmen bei Menschen mit Schlafstörungen oder metabolischen Erkrankungen wiederherzustellen. Die Forschenden heben hervor, dass der Locus coeruleus ein vielversprechender Eingriffspunkt sein könnte: Eine gezielte Reduktion seiner Erregbarkeit kann möglicherweise die Timing-Aspekte der GH-Freisetzung rekalibrieren und dadurch die Schlafkontinuität verbessern.
Für die Translation von Mausbefunden auf den Menschen sind jedoch mehrere Schritte erforderlich. Die funktionelle Konservierung von hypothalamischen und hirnstammbasierten Strukturen legt einen plausiblen Pfad nahe, doch interspezifische Unterschiede in Netzwerktopologie, Neurochemie und Verhaltensökologie müssen berücksichtigt werden. Zukünftige Studien könnten untersuchen, ob veränderte Feedback-Mechanismen zwischen GH und Schlaf zum Progress von neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit beitragen, wo Schlafstörungen und gestörte metabolische Regulation häufig koexistieren.
Darüber hinaus bieten sich methodische Erweiterungen an: nicht-invasive Bildgebungskombinationen, multisite-EEG bei Menschen, chronische Hormonmonitoring-Techniken und kontrollierte neuromodulatorische Studien (z. B. transkranielle Stimulation, tiefe Hirnstimulation in stark selektierten Fällen) könnten die Relevanz der identifizierten Schaltkreise für die menschliche Physiologie prüfen.
Expertinneneinschätzung
„Diese Aufzeichnungen geben uns einen mechanistischen Einblick, wie Übergänge zwischen Schlafphasen hormonelle Pulse steuern“, sagt Dr. Elena Martinez, Schlafneurobiologin, die nicht an der Studie beteiligt war. „Wenn ähnliche Schaltkreise beim Menschen vorhanden sind, eröffnen sich klare Möglichkeiten, Behandlungen so zu verfeinern, dass sowohl Schlafqualität als auch metabolische Gesundheit simultan adressiert werden — zwei eng miteinander verknüpfte Herausforderungen in modernen Gesellschaften.“
Dr. Martinez betont zudem, dass aufkommende Werkzeuge wie zelltypspezifische Genmodulation und nicht-invasive Hirnstimulation genutzt werden könnten, um zu prüfen, ob eine Modulation der Locus-coeruleus-Aktivität normale Wachstumshormonrhythmen wiederherstellt, ohne erhebliche Nebenwirkungen zu verursachen. Solche experimentellen Interventionen könnten wichtige Sicherheits- und Wirkungsdaten liefern, bevor klinische Anwendungen breiter erprobt werden.
Limitationen und nächste Schritte
Die Studie liefert eine belastbare Grundlage, beweist jedoch nicht, dass dieselben Schaltkreisdynamiken eins-zu-eins beim Menschen gelten. Langfristige, multimediale Humanstudien, die Polysomnographie, wiederholte Hormonanalysen und funktionelle Bildgebung oder gezielte Neuromodulation kombinieren, sind nötig, um die Übertragbarkeit zu prüfen. Ebenso muss geklärt werden, wie Alterungsprozesse, Übergewicht und neurodegenerative Veränderungen die Schlaf–GH-Rückkopplung modulieren oder stören.
Weitere offene Fragen betreffen die molekularen Identitäten der identifizierten fördernden und hemmenden Neuronen, ihre Rezeptorausstattung und wie periphere Signale (z. B. metabolische Marker, Entzündungsmediatoren) die zentralen Schaltkreise beeinflussen. Langzeitstudien könnten außerdem aufdecken, wie dauerhafte Störungen in diesem Netzwerk die Entwicklung chronischer Stoffwechsel- oder neurokognitiver Erkrankungen fördern.
Fazit
Diese Forschung kartiert einen neuronalen Schaltkreis, der die Freisetzung des Wachstumshormons über verschiedene Schlafstadien zeitlich steuert, und identifiziert den Locus coeruleus als einen Feedback-Knotenpunkt, der endokrine Signale mit Arousal verbindet. Indem gezeigt wird, wie REM- und Non-REM-Schlaf unterschiedliche Förderer und Hemmer der GH-Freisetzung aktivieren, überbrückt die Studie Schlafphysiologie und metabolische Gesundheit. Fortgesetzte Untersuchungen könnten gezielte Therapien für Schlafstörungen, metabolische Erkrankungen und Zustände mit gestörtem Schlaf-Hormon-Gleichgewicht hervorbringen.
Insgesamt liefert die Arbeit nicht nur neue biologische Einsichten, sondern öffnet auch einen praxisnahen Forschungs- und Entwicklungsweg in Richtung interventionsfähiger Targets. Sie unterstreicht die Bedeutung integrativer Ansätze, die Neurobiologie, Endokrinologie und klinische Forschung verbinden, um komplexe Gesundheitsprobleme besser zu verstehen und effektiver zu behandeln.
Quelle: sciencealert


Kommentar hinterlassen