5 Minuten
Background: why this matters for type 1 diabetes
Typ‑1‑Diabetes ist eine Autoimmunerkrankung, bei der das Immunsystem die insulinproduzierenden Inselzellen der Bauchspeicheldrüse zerstört. Die übliche Therapie besteht in lebenslangen Insulininjektionen und sorgfältiger Blutzuckerkontrolle. Das Ersetzen geschädigter Inselzellen durch funktionelle Spenderzellen – ein Verfahren, das als Inselzelltransplantation bekannt ist – wurde lange als Möglichkeit untersucht, die physiologische Insulinsekretion wiederherzustellen. Transplantierte Zellen werden jedoch meist vom Immunsystem des Empfängers als fremd erkannt, weshalb immunsuppressive Medikamente nötig sind, die erhebliche Risiken wie Infektionen und Tumorerkrankungen mit sich bringen.
Proof-of-concept human transplant using gene-edited islets
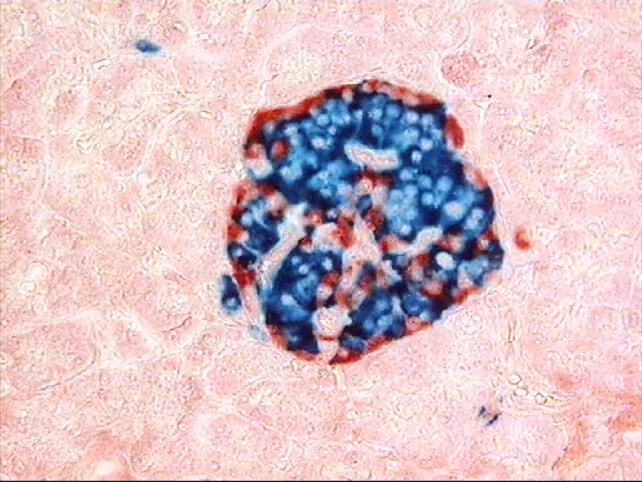
In einer wegweisenden Proof‑of‑Concept‑Studie erhielt ein 42‑jähriger Mann, der seit seinem fünften Lebensjahr an Typ‑1‑Diabetes leidet, Spender‑Inselzellen der Bauchspeicheldrüse, die genetisch so verändert worden waren, dass sie der Immunerkennung entgehen. Die Zellen wurden mehrfach in das Muskelgewebe des Unterarms injiziert. In den folgenden zwölf Wochen begannen die transplantierten Inseln, als Reaktion auf Blutzuckeranstiege – etwa nach Mahlzeiten – Insulin zu produzieren, und wichtig: der Patient benötigte keine systemische Immunsuppression.
Genetic editing strategy
Die Forschenden setzten die CRISPR‑Geneditierung ein, um drei Veränderungen an den Spender‑Inselzellen vorzunehmen, bevor diese transplantiert wurden. Zwei Modifikationen verringerten die Expression bestimmter Antigene, die adaptive T‑Zellen zur Erkennung und Attacke gegen Fremdgewebe nutzen, während die dritte Editierung die Produktion von CD47 erhöhte, einem Oberflächenprotein, das angeborene Immunreaktionen hemmt. Der Dreifach‑Edit sollte sowohl die adaptive (T‑Zell‑vermittelte) als auch die angeborene Immunität (Natürliche Killerzellen und Makrophagen) dämpfen, ohne die Gesamtimmunität des Empfängers zu unterdrücken.
Nicht alle Zellen im Transplantat trugen erfolgreiche Editierungen. Diese Variation diente als interner Vergleich: Uneditierte Zellen wurden rasch von T‑Zellen eliminiert, Zellen mit nur den Antigen‑reduzierenden Änderungen wurden weiterhin von natürlichen Killerzellen und Makrophagen angegriffen, und nur Zellen mit allen drei erfolgreichen Editierungen überlebten lange genug, um funktionell zu bleiben. Die Anwesenheit einer ausreichenden Zahl dreifach editierter Inseln im Transplantat sicherte die Insulinproduktion während des Beobachtungszeitraums.
Key results and implications
Dies ist der erste veröffentlichte humane Fall, in dem genetisch editierte Inselzellen in einem Empfänger ohne Anwendung von Immunsuppressiva funktionierten. Vortestungen an nichtmenschlichen Primaten und Nagetieren hatten bereits angedeutet, dass der Ansatz funktionieren könnte, doch frühere erfolgreiche menschliche Inselzelltransplantationen erforderten in der Regel Immunsuppression. Das Vermeiden lebenslanger immunsuppressiver Medikamente würde die langfristigen gesundheitlichen Risiken für Transplantatempfänger erheblich verringern und die klinische Anwendbarkeit von Zelltherapien deutlich erweitern.
Über den Diabetes hinaus deutet die Technik auf eine allgemein anwendbare Plattform hin, um andere Spenderzellen und Gewebetransplantate für das Wirtsimmunsystem weniger sichtbar zu machen. Gelingt die Reproduzierbarkeit und Sicherheit in größeren Studien, könnte die CRISPR‑gestützte immunentweichende Modifikation den Bedarf an Immunsuppression bei einer Reihe allogener Transplantationen verringern oder gar überflüssig machen.
Related developments and context
Parallel dazu werden autologe Verfahren weiterentwickelt, die einen Immunmismatch von vornherein ausschließen: So wurde beispielsweise kürzlich in China ein Fall beschrieben, in dem eine junge Frau insulinproduzierende Zellen aus ihren eigenen Stammzellen erhielt und eine anhaltende Blutzuckerkontrolle ohne durch Spenderzellen bedingte Immunbarrieren erreichte. Sowohl autologe Zelltherapien als auch immunentweichende allogene Transplantate sind aktive Forschungsfelder, die jeweils eigene Vorzüge und technische Herausforderungen aufweisen.
Expert Insight
„Dieses Ergebnis ist ein entscheidender Proof‑of‑Concept“, sagt Dr. Elena Martín, eine fiktive Immunologin mit Expertise in Transplantationsimmunologie. „Die Kombination aus Antigen‑Herunterregulierung und CD47‑Hochregulierung spricht sowohl die adaptive als auch die angeborene Immunität an – das ist die zentrale Innovation. Wir brauchen jedoch größere, kontrollierte Studien, um die Dauerhaftigkeit zu bestätigen, mögliche Off‑Target‑Effekte der Editierung auszuschließen und die Langzeitsicherheit zu verifizieren.“ Expertinnen und Experten betonen die Notwendigkeit sorgfältiger Überwachung auf potenzielle unbeabsichtigte Folgen, wie verändertes Verhalten des Transplantats oder seltene immunologische Komplikationen.
Conclusion
Der berichtete Fall stellt einen bedeutenden Fortschritt in Richtung zellbasierter Heilungsstrategien für Typ‑1‑Diabetes dar, da er zeigt, dass CRISPR‑editierte Inselzellen in einem menschlichen Organismus ohne systemische Immunsuppression funktionieren können. Auch wenn die Ergebnisse vorläufig sind, öffnen sie neue Wege für sicherere und breiter einsetzbare Zelltherapien und unterstreichen die Notwendigkeit fortgesetzter klinischer Studien zur Bewertung von Wirksamkeit, Sicherheit und Langzeitergebnissen.
Quelle: nejm


Kommentar hinterlassen