7 Minuten
Rapid mitochondrial 'power-up' helps cancer cells survive mechanical stress
Krebszellen setzen bei physischer Kompression einen schnellen Energieschub frei: Mitochondrien bewegen sich zügig rund um den Zellkern und liefern zusätzliches ATP. Dieser neu beschriebene Mechanismus, beobachtet sowohl in Laborversuchen als auch in Patientenproben, unterstützt die Zellen dabei, DNA‑Schäden zu reparieren und extremen mechanischen Belastungen zu trotzen.
Eine im Fachjournal Nature Communications veröffentlichte Studie aus dem Centre for Genomic Regulation (CRG) in Barcelona berichtet, dass mechanische Einschränkung unmittelbar zu einem Anstieg des nukleären ATPs führt, das von Mitochondrien bereitgestellt wird. Diese schnelle Reaktion scheint das Erbgut zu schützen, wenn Zellen mechanisch verformt werden — etwa beim Hindurchquetschen durch enge Räume im Tumormikromilieu oder beim Eintritt in Blutgefäße — und könnte einen bislang unterschätzten Beitrag zum Überleben und zur Invasion von Krebszellen leisten.
Experimentalansatz und zentrale Beobachtungen
Die Forschenden setzten ein maßgeschneidertes Live‑Cell‑Mikroskopiesystem ein, das einzelne Zellen physisch auf etwa drei Mikrometer Breite komprimiert, also ungefähr ein Dreißigstel des Durchmessers eines menschlichen Haares. Unter diesen begrenzten Bedingungen beobachtete das Team eine auffällige Umverteilung der Mitochondrien in kultivierten HeLa‑Krebszellen: Die Organellen bewegten sich zur Umhüllung und in einigen Fällen sogar in Einbuchtungen des Zellkerns und formten einen engen Halo, den die Autorinnen und Autoren als nucleus‑associated mitochondria (NAMs) beschrieben.
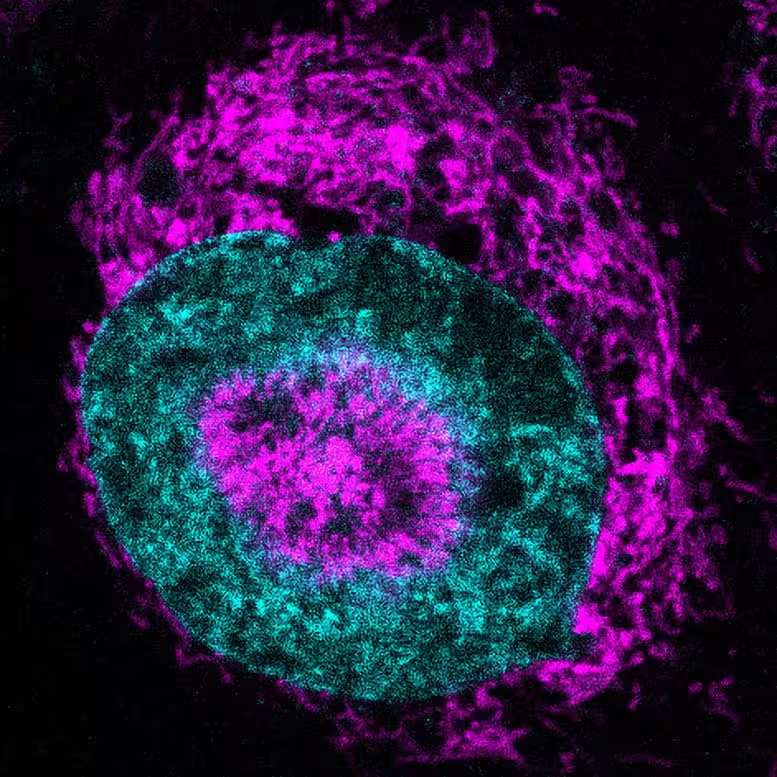
Eine komprimierte Krebszelle, bei der Mitochondrien (magenta) an der Kernperipherie (Kern in cyan) akkumulieren und innerhalb von nukleären ‚Dellen‘ (Einkerbungen) sichtbar sind. Credit: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
Um zu prüfen, ob diese Umpositionierung die nukleäre Energieversorgung beeinflusst, nutzte das Team einen fluoreszenten ATP‑Sensor, der gezielt in den Zellkern gerichtet war. Innerhalb von Sekunden nach der Kompression stieg das nukleäre ATP‑Signal um etwa 60 Prozent an. Dieser Energieschub trat in mehr als 80 Prozent der komprimierten HeLa‑Zellen auf, war jedoch in nicht komprimierten, frei schwebenden Zellen praktisch nicht vorhanden — ein Hinweis auf eine schnelle, mechanisch ausgelöste metabolische Antwort.
Warum nukleäres ATP wichtig ist
Mechanische Deformation des Zellkerns erzeugt physische Spannungen auf Chromatin und DNA. Doppelstrangbrüche und topologische Spannung erfordern ATP‑abhängige Reparaturmaschinen — Enzyme und Chromatin‑Remodeler, die Energie benötigen, um Zugang zur DNA zu erhalten und beschädigte Stellen wieder zu verschließen. Die Studie zeigte, dass Zellen mit dem NAM‑getriebenen ATP‑Anstieg DNA‑Schäden innerhalb weniger Stunden reparierten und weiter proliferierten, während Zellen, in denen diese Reaktion abgeschwächt war, die Schäden nicht auflösen konnten und eine gestörte Zellteilung zeigten.
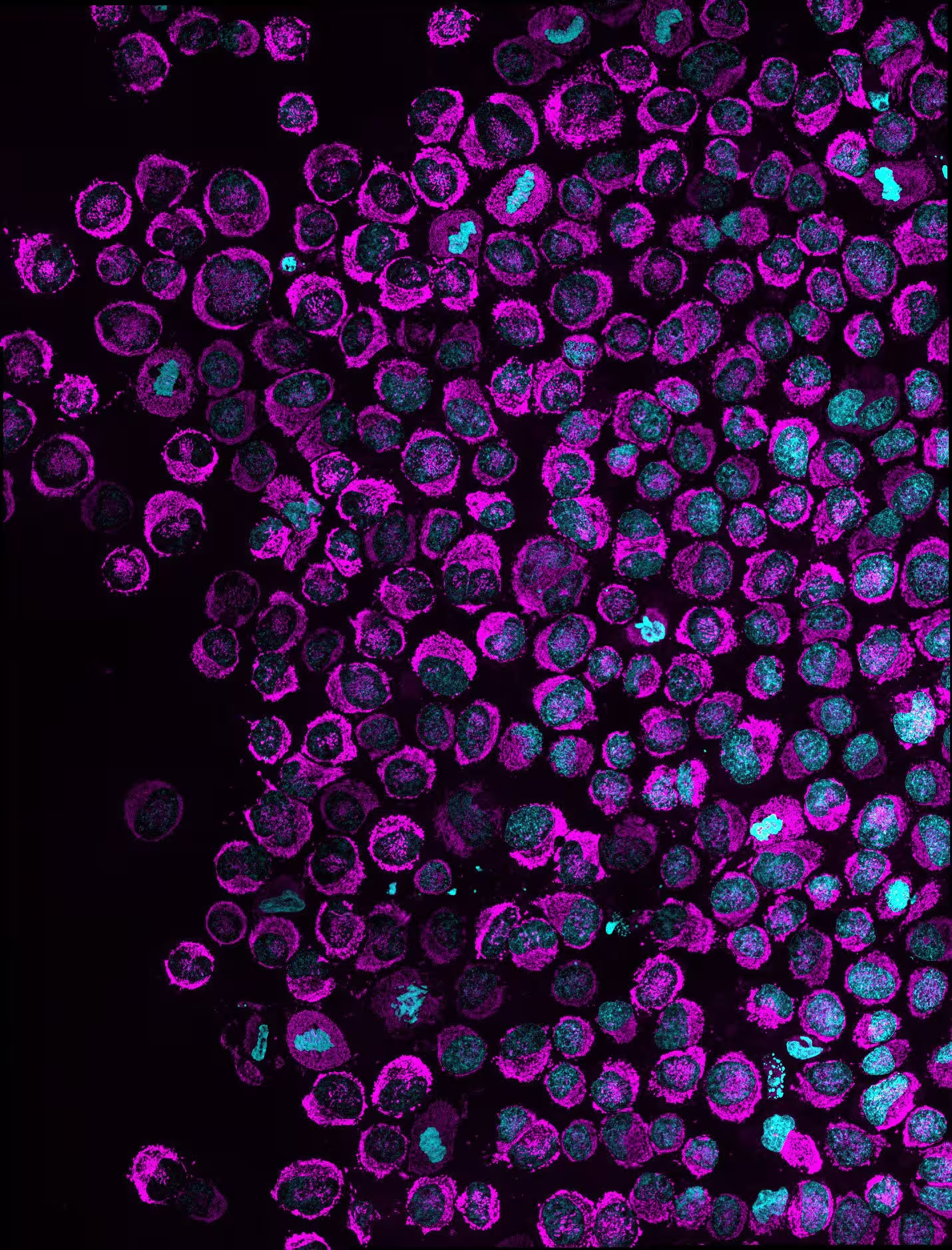
Übersicht mehrerer komprimierter Krebszellen, die Mitochondrien (magenta) und den Zellkern (cyan) zeigen. Zellen, in denen man die Ansammlung von Mitochondrien innerhalb des Kerns beobachten kann, demonstrieren das NAM‑Phänomen. In HeLa‑Zellen (im Bild) lag die Penetranz des Phänotyps in vitro bei 83,6%. Credit: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
Das zelluläre Gerüst hinter NAMs und pharmakologische Tests
Die Autorinnen und Autoren kartierten die zytoskelettären und membranösen Strukturen, die es Mitochondrien ermöglichen, sich rund um den Kern anzusammeln. Aktinfilamente verdichteten sich in der Nähe der Kernhülle, während das endoplasmatische Retikulum (ER) ein Netz bildete, das zusammen die Mitochondrien an der Kernoberfläche einfing. Das Auflösen des Aktins mit Latrunculin A zerstörte dieses Gerüst, verhinderte die NAM‑Bildung und tilgte den ATP‑Anstieg, was das zytoskelettäre Netzwerk und ER‑Mitochondrien‑Kontaktstellen als zentrale Elemente dieses Prozesses etabliert.
Diese mechanistische Einsicht eröffnet therapeutische Überlegungen: Statt die mitochondriale Funktion systemisch zu hemmen — was gesunde Gewebe stark schädigen würde — könnten Medikamente, die selektiv das Gerüst oder die mitochondrialen Befestigungen stören, die NAM‑Bildung unterdrücken. Dadurch ließe sich die Resilienz von Krebszellen gegenüber mechanischem Stress reduzieren und ihre Invasivität potenziell einschränken, ohne die gesamte mitochondriale Atmung des Körpers zu kompromittieren.
Belege aus Patientenproben und krankheitsrelevante Bedeutung
Um die klinische Relevanz zu prüfen, analysierte das Team 17 Mammakarzinom‑Biopsien. NAM‑ähnliche mitochondriale Halos traten häufiger an infiltrativen Tumorrändern (5,4% der Kerne) auf als im dichten Tumorkern (1,8%), eine etwa dreifache Anreicherung, die mit einer Rolle bei der Förderung von Invasion konsistent ist. Auch wenn der Anteil positiver Kerne im Gewebe insgesamt gering ist, stützt die räumliche Fokussierung an den invasiven Fronten die Idee, dass NAMs dort aktiv sind, wo mechanische Herausforderungen am größten sind.
Die Autorinnen und Autoren betonen, dass der Mechanismus nicht notwendigerweise auf Krebs beschränkt ist. Viele Zelltypen begegnen mechanischen Einschränkungen — etwa Immunzellen, die sich durch Lymphknoten zwängen, migratorische Neurone oder Zellen, die embryonale Formen ausbilden — und könnten ähnliche lokale ATP‑Lieferungen nutzen, um die Genomintegrität unter Stress zu bewahren. Ein Vergleich mit solchen physiologischen Prozessen könnte helfen, gemeinsame Signalwege zu identifizieren und zu verstehen, welche Elemente tumor‑spezifisch sind.
Auswirkungen auf Metastasierung und Therapie
Diese Entdeckung rückt Mitochondrien als dynamische Akteure ins Zentrum, die rasch zu den Bereichen mit dem höchsten Bedarf mobilisiert werden können, statt als passive Zellbatterien zu fungieren. Für die Onkologie ergeben sich zwei zentrale Implikationen: Erstens können NAM‑getriebene ATP‑Pulse zirkulierenden oder invadierenden Krebszellen helfen, die mechanischen Anforderungen der Metastasierung zu überstehen; zweitens stellt die molekulare Maschinerie, die NAMs erzeugt, eine potenzielle Schwachstelle dar. Die gezielte Blockade von Aktin‑Gerüsten, ER‑Mitochondrien‑Kontaktstellen oder der Signalwege, die die mitochondriale Umlagerung auslösen, könnte die metastatische Kompetenz reduzieren, möglicherweise mit geringerer Toxizität als globale Inhibitoren der mitochondrialen Aktivität.
Die Erstautorinnen und Koautorinnen hoben den konzeptionellen Wandel hervor. „Es zwingt uns, die Rolle der Mitochondrien im menschlichen Körper neu zu denken. Sie sind keine statischen Batterien, die unsere Zellen einfach antreiben, sondern eher agile Ersthelfer, die in Notfällen gerufen werden können, wenn Zellen buchstäblich bis an ihre Grenzen gedrückt werden“, sagte Dr. Sara Sdelci, gemeinsame Korrespondenzautorin. Co‑Erstautor Dr. Fabio Pezzano ergänzte: „Es ist ein klares Zeichen dafür, dass sich Zellen an die Belastung anpassen und ihren Stoffwechsel umstrukturieren.“
Co‑Erstautor Dr. Ritobrata (Rito) Ghose stellte fest, dass das Vorhandensein von NAMs in Patientenbiopsien die klinische Relevanz der Entdeckung untermauerte: Die Beobachtung dieses Signaturmusters außerhalb des Labors überzeugte das Team davon, dass das Phänomen in Tumoren Bedeutung hat. Co‑Korrespondenzautorin Dr. Verena Ruprecht regte an, mechanische Stressantworten als bislang wenig erforschte Verwundbarkeit der Krebsbiologie zu betrachten, die neue therapeutische Wege eröffnen könnte.
Expert Insight
"Diese Arbeit verbindet elegant mechanische Kräfte mit subzellulärer Energieredistribution und DNA‑Reparatur", sagt Dr. Elaine Morgan, eine Zellbiologin (fiktive Expertin) mit Schwerpunkt Zytoskelettmechanik. "Wenn wir die molekularen Anker definieren können, die Mitochondrien während der Kompression verankern, könnte man kleine Moleküle oder Biologika entwickeln, die diese Umlagerung in Tumorzellen gezielt blockieren, ohne den systemischen Stoffwechsel zu stören. Das wäre ein großer Fortschritt für anti‑metastatische Therapien."
Conclusion
Die Entdeckung der nucleus‑associated mitochondria (NAMs) und ihrer schnellen ATP‑Zufuhr unter mechanischer Einengung eröffnet eine neue Ebene zellulärer Anpassung. Indem Mitochondrien Energie direkt an den Zellkern liefern, tragen sie dazu bei, die Genomintegrität während physischem Stress aufrechtzuerhalten — eine Fähigkeit, die Krebszellen ausnutzen, um zu überleben und zu invadieren. Die Kartierung der strukturellen und Signalbestandteile dieser Reaktion identifiziert Kandidaten, um Metastasen zu begrenzen und gleichzeitig gesundes Gewebe zu schonen. Weitere Forschung ist notwendig, um zu klären, wie verbreitet die NAM‑Bildung in verschiedenen Zelltypen ist und ob selektive Inhibitoren entwickelt werden können, die diesen mechanischen Überlebensschalter bei Krebs sicher blockieren.
Quelle: scitechdaily

Kommentar hinterlassen