8 Minuten
Forscher haben eine gemeinsame genetische Architektur identifiziert, die acht große psychiatrische Störungen verknüpft und damit neue Einsichten liefert, warum diese Krankheiten oft gemeinsam auftreten und familiär gehäuft vorkommen. Eine Studie, veröffentlicht in Cell (Won et al., 2025), kartierte spezifische Genvarianten, die über mehrere Entwicklungsphasen des Gehirns und in unterschiedlichen Zelltypen wirken — Hinweise, die breit wirkende Therapieansätze denkbar machen.
Hintergrund & Studiendesign: Warum die Frage wichtig ist
Warum das Thema Relevanz hat
Psychiatrische Diagnosen überschneiden sich klinisch häufig: Bis zu 70 % der Menschen mit Autismus oder ADHS erfüllen irgendwann die Kriterien für die jeweils andere Störung. Solche Komorbiditäten und familiäre Häufungen legen nahe, dass gemeinsame genetische Ursachen eine große Rolle spielen. Die neue Arbeit nähert sich diesem Problem über das Konzept der Pleiotropie — also der Eigenschaft einzelner genetischer Varianten, mehrere Merkmale oder Erkrankungen zu beeinflussen — und fragt konkret: Wann, wo und wie wirken diese Varianten im sich entwickelnden Gehirn?
Experimenteller Ansatz: Von Varianten zu funktionaler Wirkung
Das Forscherteam begann mit einem großen Datensatz: nahezu 18.000 genetische Varianten, ausgewählt aus sowohl störungsspezifischen als auch gemeinsamen Gen-Sets, die zuvor in groß angelegten genomweiten Assoziationsstudien (GWAS) mit acht psychiatrischen Erkrankungen verknüpft worden waren. Statt allein statistische Assoziationen zu melden, verfolgte die Studie einen funktionellen Ansatz: Die Varianten wurden in menschliche neuronale Vorläuferzellen eingeführt, jene Vorläufer, aus denen später spezialisierte Neuronen und andere Gehirnzellen entstehen. Während einer simulierten Entwicklung erfassten die Forschenden, wie jede Variante Genexpression und regulatorische Netzwerke veränderte. Wichtige regulatorische Effekte validierten sie zudem in sich entwickelnden Mäusen, um cross-species-Funktionsrelevanz zu prüfen.
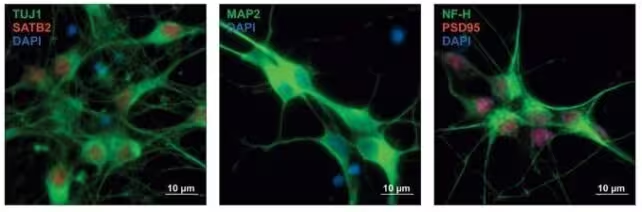
Bild: Menschliche Vorläuferneuronen mit unterschiedlich gefärbter Proteinexpression — ein Fenster in frühe Entwicklungsstadien (Won et al., Cell, 2025).
Zentrale Ergebnisse: Pleiotrope Varianten als Netzwerkknoten
Die Studie identifizierte 683 Varianten, die die Genregulation in neuronalen Vorläuferzellen veränderten. Innerhalb dieser Treffergruppe zeigten pleiotrope Varianten charakteristische Muster, die ihre besondere Bedeutung für die gemeinsame Pathogenese psychiatrischer Störungen erklären:
- Höhere Netzwerk-Konnektivität: Pleiotrope Varianten betreffen Gene, deren Proteine deutlich mehr Protein–Protein-Interaktionen eingehen als störungsspezifische Gene. Eine Veränderung an einem solchen Knoten kann weitreichende Auswirkungen haben und zahlreiche molekulare Pfade beeinflussen.
- Breitere Zelltyp- und Zeitfensteraktivität: Diese Varianten bleiben in mehreren Gehirnzelltypen aktiv und über längere Entwicklungsphasen hinweg relevant. Dadurch können sie auf verschiedenen Etappen der Schaltkreisbildung wirken und je nach Zeitpunkt unterschiedliche klinische Erscheinungsbilder begünstigen.
- Regulatorische Kaskadeneffekte: Pleiotrope Varianten modulieren Genregulationsmechanismen über Entwicklungsstadien hinweg — also nicht nur ein lokaler Effekt, sondern veränderte Transkriptions- oder Enhancer-Aktivität, die später weitergereicht wird.
Hyejung Won, Genetikerin an der University of North Carolina, fasst es so zusammen: Die von diesen Genen produzierten Proteine seien eng mit vielen anderen Proteinen vernetzt. Veränderungen an genau diesen Stellen könnten sich durch das Netzwerk ausbreiten und großflächige Effekte im Gehirn auslösen. Diese netzwerkzentrierte Perspektive macht pleiotrope Varianten zu potenziell hochwirksamen Hebelpunkten für Risiko und Intervention.
Mechanistische Einsichten: Wie aus Varianten Wirkungen werden
Die funktionalen Daten deuten auf mehrere mechanistische Ebenen hin, die erklären, wie gemeinsame genetische Treiber sich in unterschiedliche klinische Phänotypen übersetzen können:
1) Zelltypabhängige Wirkung und Entwicklungszeitpunkte
Ein Gen, das in frühen neuronalen Vorläufern stark reguliert wird, kann die Bildung ganzer Zellpopulationen beeinflussen — etwa die Balance von erregenden und hemmenden Neuronen. Dieselbe Variante kann später in differenzierten Interneuronen noch andere Funktionen haben. Weil das Gehirn in klar abgegrenzten Entwicklungsphasen arbeitsteilig aufgebaut wird, verändert dieselbe molekulare Störung je nach Zeitpunkt die daraus folgenden Schaltkreise unterschiedlich.
2) Netzwerkdynamik und Konnektivität
Proteine, die viele Interaktionspartner haben (so genannte Hub-Proteine), bestimmen die Robustheit und Flexibilität zellulärer Netze. Varianten, die diese Hub-Proteine betreffen, lösen oft Kaskaden aus — von veränderter Signalweitergabe bis zu verschobener Transkriptionsregulation. Das erklärt, warum kleine Veränderungen bei zentralen Komponenten große klinische Variabilität erzeugen können.
3) Genregulatorische Veränderungen: Enhancer, Promotoren und Transkriptionsfaktoren
Viele der identifizierten Varianten scheinen nicht die Proteinsequenz zu verändern, sondern die Genregulation — also die Stärke, den Ort und die Zeit, zu der ein Gen abgelesen wird. Varianten in Enhancern oder Bindungsstellen für Transkriptionsfaktoren können feine, aber langfristige Änderungen in Expressionsprogrammen verursachen. Solche regulatorischen Effekte sind besonders plausibel, um pleiotrope Wirkungen zu vermitteln.
Was das für Diagnose und Therapie bedeuten könnte
Die Aufdeckung gemeinsamer genetischer Treiber hat unmittelbare Konsequenzen für Forschung, Diagnostik und Behandlung psychiatrischer Erkrankungen:
- Neuordnung diagnostischer Konzepte: Wenn dieselben genetischen Faktoren mehreren Störungen zugrunde liegen, stellt das traditionelle, rein symptombasierte Klassifikationssystem Fragen. Eine stärker biologisch informierte Einordnung könnte Komorbiditäten und Überlappungen besser erklären.
- Gemeinsame therapeutische Ziele: Medikamente oder biologische Interventionen, die zentrale Netzwerk-Knoten stabilisieren oder regulatorische Pfade normalisieren, könnten potenziell Symptome bei mehreren Erkrankungen lindern. Solche breit wirksamen Therapien wären für die öffentliche Gesundheit besonders attraktiv.
- Personalisierte Prävention: Kenntnis pleiotroper Risikovarianten erlaubt, Risikoprofile früh zu erkennen und gezielte Präventionsstrategien zu entwickeln — besonders in Familien mit gehäuften psychiatrischen Erkrankungen.
Die Weltgesundheitsorganisation schätzt, dass etwa 1 von 8 Menschen weltweit eine psychiatrische Erkrankung erlebt — knapp eine Milliarde Menschen. Deshalb könnten Therapien, die auf gemeinsame Ursachen abzielen, eine große gesundheitspolitische Wirkung entfalten.
Forschungsperspektiven: Was jetzt noch zu tun ist
Obwohl die Studie substanzielle Fortschritte macht, bleiben viele Fragen offen — und sie bietet zugleich klare Leitlinien für kommende Arbeiten:
- Feinere funktionelle Validierung: Die Validierung in Mausmodellen unterstützt die Relevanz über Spezies hinweg, doch die Komplexität menschlicher Gehirnentwicklung verlangt zusätzliche Modelle, etwa organoide Systeme, longitudinale in vivo-Analysen und perturbative Experimente auf Einzelzell-Ebene.
- Interaktion Gen–Umwelt: Pleiotrope Varianten schaffen eine Verwundbarkeit, die durch Umweltfaktoren modulierbar ist. Künftige Studien sollten untersuchen, wie Stress, Ernährung, Infektionen oder pränatale Bedingungen die Wirkung dieser Varianten verstärken oder abschwächen.
- Pharmakologische Targets: Identifizierte Netzwerk-Hubs liefern Kandidaten für Wirkstoffentwicklung, aber auch für nicht-pharmakologische Interventionen wie neuromodulative Verfahren. Zielgerichtete Modulatoren, die regulatorische Gleichgewichte wiederherstellen, könnten mehrere Diagnosen adressieren.
- Translation in die Klinik: Um von genetischen Entdeckungen zu Therapien zu gelangen, braucht es Biomarker, präklinische Validierung und klinische Studien, die über einzelne Diagnosen hinweg konzipiert sind.
Ein Beispiel: Stellen Sie sich eine Variante vor, die in frühen Vorläuferzellen die Ausbildung bestimmter Inhibitorneuronen abschwächt. Frühe Interventionen, die die Balance zwischen erregenden und hemmenden Signalen wiederherstellen, könnten dann das spätere Risiko für Schizophrenie, Autismus oder affektive Störungen vermindern — unabhängig von der späteren klinischen Einschätzung.
Wissenschaftliche Strenge und Grenzen der Studie
Kein einzelner Ansatz kann alle Aspekte komplexer psychischer Erkrankungen erklären. Die Studie punktet mit einer robusten funktionellen Strategie und Cross-Species-Validierung, doch bleibt die Übersetzung in klinische Praxis herausfordernd. Einschränkungen, die forciert adressiert werden sollten:
- Populationen und genetische Vielfalt: Viele GWAS beruhen auf Bevölkerungsdaten mit europäischer Dominanz. Die Generalisierbarkeit in global diverseren Populationen muss geprüft werden.
- Modellbeschränkungen: Zellkultur-Modelle und Mausmodelle bilden Teile menschlicher Neuroentwicklung nach, ersetzen jedoch nicht die volle Komplexität des menschlichen Gehirns.
- Effektstärken: Einzelne Varianten haben oft kleine Effekte; ihre klinische Relevanz ergibt sich aus Kombinationen und Netzwerk-Effekten.
Dennoch liefert die Arbeit eine klare strategische Roadmap: Von statistischer Assoziation zu funktioneller Einsicht — und von dort zu therapeutischen Hypothesen.
Die Entdeckung pleiotroper Varianten als gemeinsame genetische Treiber bietet Forschenden und Klinikern ein neues Framework, um Überschneidungen zwischen Autismus, ADHS, Schizophrenie, bipolarer Störung, schwerer Depression, Tourette-Syndrom, Zwangsstörung und Anorexie zu verstehen. Indem man die molekularen Netzwerke aufschlüsselt, die diesen Erkrankungen zugrunde liegen, öffnet sich das Feld für interventionsorientierte Forschung, die über einzelne Diagnosen hinaus Wirkung entfalten kann.
Ausblick: Die Studie markiert einen wichtigen Schritt in Richtung einer vernetzten Neurogenetik — einer Perspektive, die Developmental Timing, Zelltyp-Spezifität und molekulare Netzwerke kombiniert. Wer die Karte der pleiotropen Varianten weiter verfeinert, bringt uns näher an Therapien, die nicht nur Symptome lindern, sondern gemeinsame Ursachen adressieren.
Quelle: sciencealert

Kommentar hinterlassen