9 Minuten
Die Verleihung des Nobelpreises 2025 an Shimon Sakaguchi, Mary E. Brunkow und Fred Ramsdell würdigt eine Entdeckung, die das Verständnis des Immunsystems grundlegend verändert hat: spezialisierte regulatorische T‑Zellen (T‑regs) halten das Immunsystem im Gleichgewicht und verhindern, dass es sich gegen den eigenen Körper richtet. Ihre Arbeit erklärt, wie Immuntoleranz aktiv gesteuert wird und öffnet Wege zu neuen Therapien gegen Autoimmunerkrankungen, für die Transplantationsmedizin und die Krebsbehandlung.
Warum diese Entdeckung die Immunologie umkrempelt
Lange galt die Auffassung, dass die Unterscheidung von Eigen- und Fremdmaterial überwiegend durch negative Selektion im Thymus erfolgt: Selbstreaktive T‑Zellen würden früh entfernt und so Autoimmunität verhindert. Die Nobelpreisträger zeigten jedoch, dass dieser Mechanismus nicht ausreicht. Regulatorsiche T‑Zellen stellen eine aktive, periphere Kontrollinstanz dar, die lebend und dynamisch laufende Immunreaktionen dämpft. Stellen Sie sich das Immunsystem wie eine Stadt vor: Die T‑regs sind die Einsatzkräfte, die dafür sorgen, dass Proteste nicht in Zerstörung umschlagen.
Die Preisträger und ihr Beitrag
Shimon Sakaguchi beobachtete bereits in den 1990er Jahren, dass das Entfernen bestimmter T‑Zellen bei Mäusen Autoimmunreaktionen auslösen kann. Seine Experimente führten zur Beschreibung einer Zellpopulation, die Autoimmunität unterdrückt. Mary Brunkow und Fred Ramsdell konnten später die molekulare Grundlage dieses Phänotyps aufklären: das Transkriptionsfaktorprotein FoxP3 wurde als zentrales Merkmal und Regulator dieser Zellen identifiziert. Zusammen verknüpfen diese Arbeiten physiologische Beobachtung mit molekularer Mechanik — ein klassisches Beispiel für translationale Forschung.
Wissenschaftlicher Hintergrund: T‑Zellen, Thymus und periphere Toleranz
T‑Lymphozyten reifen im Thymus, wo viele selbstreaktive Klone durch negative Selektion eliminiert werden. Doch diese zentrale Toleranz ist lückenhaft: Einige autoreaktive T‑Zellen entkommen und können unter bestimmten Bedingungen Schäden anrichten. Genau hier greifen T‑regs ein. Sie agieren im peripheren Immunsystem, also außerhalb des Thymus, und sorgen dafür, dass potenziell schädliche Reaktionen unterdrückt werden. Das erklärt, warum viele Menschen trotz Präsenz autoreaktiver Rezeptoren gesund bleiben.
Sakaguchis Schlüsselerkenntnisse
In eleganten Transferexperimenten zeigte Sakaguchi, dass die Präsenz bestimmter T‑Zellen verhindert, dass andere T‑Zellen autoaggressiv werden. Mäuse ohne diese Zellpopulation entwickelten Symptome, die an menschliche Autoimmunstörungen erinnerten. Diese Arbeit veränderte die Hypothese von einer passiven Eliminierung zu einem aktiven System der Unterdrückung.
Wie regulatorische T‑Zellen funktionieren
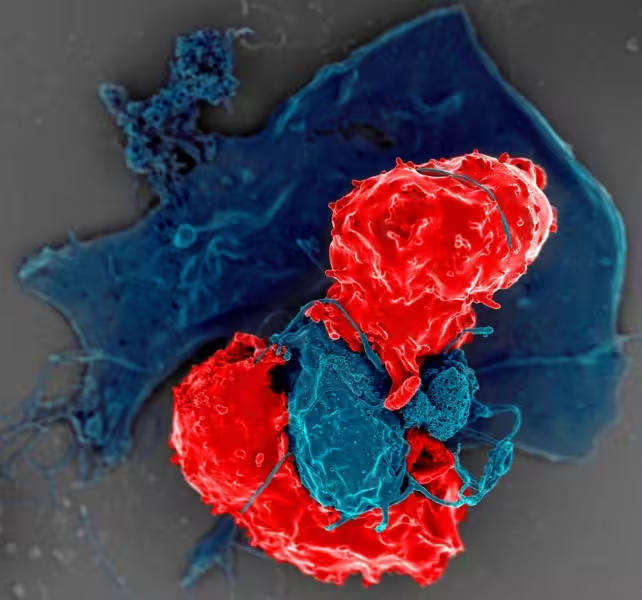
Regulatorische T‑Zellen (häufig CD4+CD25+FoxP3+ in der Beschreibung) unterdrücken Immunreaktionen durch ein Bündel miteinander verknüpfter Mechanismen. Diese Redundanz erklärt, warum das System robust ist: Fallen eine oder zwei Unterdrückungswege aus, können andere einspringen. Folgende Grundprinzipien sind wesentlich:
Mechanismen und Marker
- FoxP3: Ein Schlüsselfaktor, der die Entwicklung, Identität und Funktion von T‑regs steuert. Mutationen im FoxP3‑Gen führen beim Menschen zu schweren Autoimmunerkrankungen (wie dem IPEX‑Syndrom), was seine zentrale Rolle unterstreicht.
- Zytokinvermittelte Suppression: T‑regs produzieren antiinflammatorische Zytokine wie IL‑10 und TGF‑β, die lokale Immunreaktionen dämpfen und die Aktivität effektorischer T‑Zellen reduzieren.
- Wachstumsfaktorkonsum: Durch hohe Expression des IL‑2‑Rezeptors verbrauchen T‑regs lokal IL‑2, ein lebenswichtiges Zytokin für Effektor‑T‑Zellen, und entziehen so aktiv diesen Zellen notwendige Signale.
- Direkte Zell‑Zell‑Interaktion: Über Moleküle wie CTLA‑4 beeinflussen T‑regs dendritische Zellen und reduzieren deren Fähigkeit zur Antigenpräsentation und Aktivierung effektorischer T‑Zellen.
- Metabolische Regulation: T‑regs modulieren den Stoffwechsel in ihrem Umfeld, z. B. durch Adenosinproduktion, was wiederum entzündliche Reaktionen unterdrückt.
Das Zusammenspiel dieser Mechanismen macht T‑regs zu flexiblen Schiedsrichtern des Immunsystems. Ihre Identifikation durch FoxP3 ermöglichte es Forschern erstmals, T‑regs gezielt zu isolieren, charakterisieren und gentechnisch zu manipulieren — eine Voraussetzung für therapeutische Anwendungen.
Klinische Implikationen: Von Autoimmunerkrankungen bis zur Krebsmedizin
Die Entdeckung regulatorischer T‑Zellen hat direkte Konsequenzen für eine Vielzahl medizinischer Bereiche. Sie erklärt Pathophysiologie, bietet Biomarker für Diagnostik und eröffnet therapeutische Wege. Einige Bereiche stechen besonders hervor:
Autoimmunerkrankungen
Bei Erkrankungen wie Typ‑1‑Diabetes, rheumatoider Arthritis oder Multipler Sklerose zeigen Studien häufig reduzierte Anzahl oder eingeschränkte Funktion von T‑regs. Therapeutische Strategien zielen daher darauf, T‑reg‑Zahlen zu erhöhen, ihre Stabilität zu stärken oder ihre Antigenspezifität zu verfeinern, sodass nur krankheitsrelevante Immunantworten gedämpft werden, während die allgemeine Immunabwehr intakt bleibt. Ansätze reichen von adoptiven Zelltherapien (Transfer ex vivo expandierter T‑regs) bis zu Medikamenten, die FoxP3 positiv beeinflussen.
Transplantationsmedizin
Langjährige Immunsuppression nach Organtransplantation erhöht Infektionsrisiken und Toxizität. T‑reg‑Therapien sollen dieses Dilemma lindern, indem sie gezielt Toleranz gegenüber dem Transplantat fördern. Erste klinische Studien zeigen, dass adoptiv übertragene T‑regs Abstoßungsreaktionen reduzieren und ermöglichen könnten, die Dosis systemischer Immunsuppressiva zu senken.
Krebsimmuntherapie
Während T‑regs in Autoimmunität schützend wirken, sind sie in Tumorumgebungen oft unerwünscht: Sie hemmen antitumorale Immunreaktionen und tragen so zur Immuntoleranz des Tumors bei. Therapeutische Strategien differenzieren daher zwischen dem Verstärken von T‑regs (bei Autoimmunität) und ihrem gezielten Aufheben (bei Krebs). Beispiele sind Checkpoint‑Inhibitoren, die zwar breitere Effekte haben, und neuere Ansätze, die T‑regs spezifisch anvisieren, um Nebenwirkungen zu begrenzen.
Impfungen und Infektionskrankheiten
T‑regs beeinflussen die Stärke und Dauer von Impfantworten. Ein zu starkes regulatorisches Umfeld kann die Effektivität einer Impfung dämpfen; ein zu schwaches erlaubt überschießende Entzündungen. Das Verständnis der T‑reg‑Dynamik hilft, Impfstoffdesign und Adjuvantien so zu optimieren, dass Schutz und Sicherheit in Balance bleiben.
Insgesamt eröffnet die Regulierung durch T‑regs einen translationalen Forschungspfad: Medikamente und Zelltherapien, die entweder T‑reg‑Funktion unterstützen oder selektiv blockieren, sind bereits in Entwicklung und werden in klinischen Studien erprobt.
Technische Entwicklungen und innovative Therapiekonzepte
Die Forschung an T‑regs ist inzwischen ein interdisziplinäres Feld: Immunologie, Zellbiologie, Genomik, Bioengineering und klinische Forschung arbeiten eng zusammen. Wichtige Trends und Technologien sind:
Adoptive T‑reg‑Therapien
Hierbei werden aus dem Patienten oder einem Spender T‑regs entnommen, ex vivo expandiert und wieder übertragen. Entscheidend ist dabei, die Stabilität und Antigenspezifität der Zellen zu sichern, damit sie langfristig tolerierend wirken. Fortschritte in der Zellkultur, GMP‑Produktion und Qualitätskontrolle machen diese Therapien zunehmend praktikabel.
CAR‑T‑reg und gentechnische Ansätze
Analog zur CAR‑T‑Zelltherapie bei Krebs werden T‑regs gentechnisch mit chimären Antigenrezeptoren (CARs) ausgestattet, um sie zielgerichtet an bestimmte Gewebe oder Antigene zu lenken. CAR‑T‑regs könnten zum Beispiel auf ein transplantiertes Organ oder ein Gewebe‑spezifisches Autoantigen ausgerichtet werden, um lokale Toleranz zu schaffen, ohne das gesamte Immunsystem zu dämpfen.
Small molecules und biologische Modulatoren
Forschende suchen nach kleinen Molekülen oder Antikörpern, die FoxP3‑Stabilität, T‑reg‑Differenzierung oder -Funktion positiv beeinflussen. Solche Wirkstoffe könnten die Vorteile zellbasierter Therapien mit der Skalierbarkeit von Medikamenten kombinieren.
Präzisionsmedizin und Antigenspezifität
Der Schlüssel zur Nebenwirkungsminimierung liegt in der Antigenspezifität: Wenn T‑regs nur gegen krankheitsrelevante Antigene gerichtet werden, bleibt die übrige Immunantwort intakt. Technologien wie Single‑Cell‑Sequencing, T‑Zell‑Rezeptor‑Profiling und synthetische Biologie helfen dabei, solche spezifischen T‑reg‑Klone zu identifizieren und zu vermehrten Zellprodukten zu machen.
Mikrobiom, Umweltfaktoren und epigenetische Regulation
Das Mikrobiom beeinflusst die T‑reg‑Entwicklung und -Funktion stark: Bestimmte Darmbakterien fördern die Ausbildung tolerogener T‑Zellen. Ebenso modulieren Umwelteinflüsse und epigenetische Veränderungen die Stabilität von FoxP3‑Expression. Diese Erkenntnisse eröffnen zusätzliche Interventionspunkte wie Probiotika, Ernährungsinterventionen oder epigenetische Modulatoren.
Forschungshürden und ethische Fragen
Trotz beeindruckender Fortschritte gibt es Herausforderungen. Die Langzeitstabilität transfundierter T‑regs, das Risiko einer übermäßigen Immunsuppression, die Herstellungskosten und die Regulatory‑Hürden für zellbasierte Therapien sind zentrale Punkte. Zudem stellen sich ethische Fragen bei gentechnisch veränderten Zellen: Wie lassen sich Risiken minimieren, wie transparent muss man Patienten gegenüber sein, und wie gerecht verteilt man solche oft teuren Therapien?
Sicherheitsüberlegungen
Ein spezifisches Risiko besteht darin, dass T‑regs in bestimmten Kontexten Immuntoleranz gegenüber Tumoren fördern könnten. Deshalb ist eine präzise Selektion und Steuerung der Therapieparameter essenziell. Konzepte wie Einschalt‑/Ausschaltmechanismen in gentechnisch veränderten Zellen oder kurzlebige, wiederholbare Behandlungszyklen werden intensiv diskutiert.
Expertinnenstimme
"Die Identifikation regulatorischer T‑Zellen hat das Denken über Immunbalance tiefgreifend verändert", sagt Dr. Elena Martinez, Immunologin und Wissenschaftskommunikatorin. "Statt sich allein auf das Entfernen schädlicher Zellen zu konzentrieren, geht es nun darum, tolerogene Lösungen gezielt zu entwerfen — sei es zur Wiederherstellung von Toleranz bei Autoimmunerkrankungen oder zum gezielten Aufheben von Bremsen im Kampf gegen Tumoren. Die Nobelpreisverleihung würdigt nicht nur eine grundlegende Erkenntnis, sondern auch das enorme therapeutische Potenzial."
Was als Nächstes kommt
Die nächsten Jahre werden zeigen, wie schnell T‑reg‑basierte Therapien den Weg in die Klinik finden und welche Indikationen zuerst profitieren. Prioritäten sind die Verbesserung der antigenspezifischen Expansion, die Entwicklung von Wirkstoffen zur Stabilisierung von FoxP3, sowie die Kombination von T‑reg‑Strategien mit etablierten Therapien wie biologischen Medikamenten oder Checkpoint‑Inhibitoren. Parallel dazu werden Grundlagenstudien zur Interaktion von T‑regs mit dem Mikrobiom, dem metabolischen Milieu und anderen Immunzelltypen die Grundlage für sichere, präzise Therapiekonzepte liefern.
Die Entdeckung von Sakaguchi, Brunkow und Ramsdell ist ein Paradebeispiel für Forschung, die von der Grundlagenfrage zur klinischen Anwendung führt: Sie zeigt, wie das Ergründen eines biologischen Prinzips — hier der aktiven Immuntoleranz — ganze Therapiefelder prägen kann. Forscher, Kliniker und die Biotechnologiebranche arbeiten bereits daran, dieses Wissen in wirksame, zugängliche Therapien zu verwandeln, die in Zukunft Millionen Patienten helfen könnten.
Quelle: sciencealert

Kommentar hinterlassen