8 Minuten
Eine neuartige hybride Immunzelltherapie hat Typ‑1‑Diabetes bei Mäusen vollständig verhindert und in bereits erkrankten Tieren rückgängig gemacht, ohne langfristige Immunsuppression, berichten Forscher der Stanford School of Medicine. Durch die Erzeugung eines gemischten Immunsystems, das Zellen sowohl des Spenders als auch des Empfängers enthält, konnte das Team die insulinproduzierenden Inselzellen wiederherstellen und den autoimmunen Angriff, der die Erkrankung auslöst, blockieren. Diese Studie kombiniert Zelltransplantation mit immunologischer Neukalibrierung und liefert damit einen integrativen Ansatz, der sowohl auf die Wiederherstellung der Betazellfunktion als auch auf die Induktion von donor-spezifischer Immuntoleranz abzielt.
Warum dieser Ansatz wichtig ist: Reset des Immunsystems und Ersatz von Inseln
Typ‑1‑Diabetes ist eine Autoimmunerkrankung, bei der das Immunsystem die insulinproduzierenden Betazellen der Pankreas‑Inseln fälschlich als Fremdkörper erkennt und zerstört. Ohne diese Zellen bricht die Insulinproduktion zusammen, und die Regulation des Blutzuckers ist nicht mehr gegeben. Konventionelle Inselzelltransplantationen können zwar die Insulinproduktion temporär wiederherstellen, doch transplantierte Zellen sind derselben autoimmunen Zerstörung ausgesetzt — Patienten benötigen häufig lebenslange immunsuppressive Therapien, um Abstoßung und erneute Autoimmunreaktionen zu verhindern. Diese systemische Immunsuppression ist mit erheblichen Nebenwirkungen verbunden, etwa Infektionsrisiken, Malignitätsrisiken und Organtoxizität.
Das Stanford‑Team verfolgte einen anderen Weg: Anstatt nur Inseln zu ersetzen, bereiteten sie die Empfänger so vor, dass deren Immunsystem Spenderzellen akzeptieren und mit ihnen in einem ausgewogenen Zustand koexistieren kann. Die hybride Strategie kombiniert hämatopoetische (blutbildende) Stammzellen des Spenders mit gesunden Spender‑Inselzellen und einem Konditionierungsprotokoll, das das Empfänger‑Immunsystem subtil neu startet. Das Ergebnis ist ein chimäres oder hybrides Immunsystem, das sowohl empfänger‑ als auch spenderabgeleitete Immunzellen enthält und die transplantierten Inseln toleriert, ohne dass eine kontinuierliche systemische Immunsuppression erforderlich wäre. Diese Form der kontrollierten Chimärismus‑Induktion zielt darauf ab, Antigen‑spezifische Toleranz zu schaffen — also gezielt Toleranz gegenüber den Transplantatzellen, während die übrige Immunantwort intakt bleibt.
Wie das Experiment funktionierte: Konditionierung, Transplantation und Toleranz
In der Studie erhielten prädiabetische und bereits diabetische Mäuse ein kurzes Konditionierungsprotokoll: eine begrenzte Behandlung mit einem Immunsysteminhibitor, niedrig dosierte Bestrahlung und ausgewählte Antikörper, die bestimmte Immunzellpopulationen reduzieren sollten, ohne das gesamte Immunsystem zu zerstören. Ziel war eine partielle Immundefizierung, die ausreichend Raum im hämatopoetischen Nischenmikromilieu schafft, damit Spenderstammzellen ansprechen und sich etablieren können, aber die allgemeine Abwehrlage und das Wohlbefinden des Tieres bewahrt bleiben. Parallel wurden Spender‑Blutstammzellen zusammen mit gesunden Spender‑Inseln infundiert, damit sowohl die Immun‑ als auch die Inselzellkomponente des Therapiekonzepts gleichzeitig implementiert werden konnten.
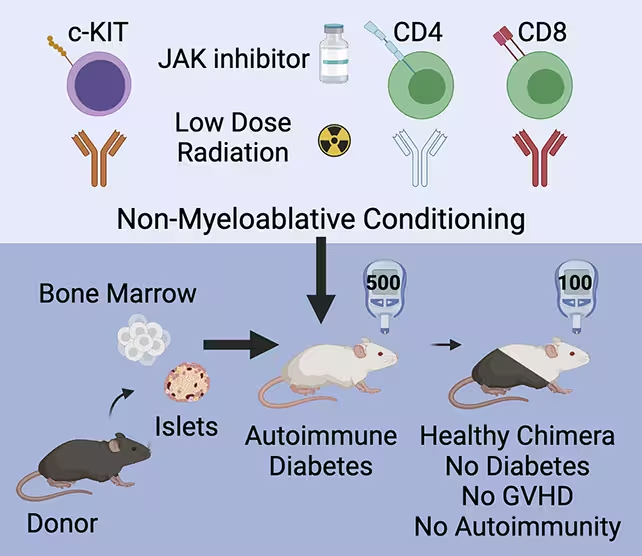
Die Tiere erhielten eine Konditionierungsbehandlung, um ihr Immunsystem auf die Zelltransplantation vorzubereiten.
Die milde Konditionierung ermöglichte es den Spenderstammzellen, im Empfänger anzusiedeln und eine Population spenderabgeleiteter Immunzellen zu produzieren, die neben den körpereigenen Immunzellen koexistierte. Anstatt eine Graft‑versus‑Host‑Erkrankung (GvHD) auszulösen — eine häufige Komplikation, wenn Zellen eines Individuums das Gewebe eines anderen angreifen — hielten die hybrid behandelten Tiere ein immunologisches Gleichgewicht aufrecht. Die transplantierten Inseln wurden geschützt, die Betazellfunktion erholte sich, und der Blutzucker normalisierte sich bei Mäusen mit etabliertem Diabetes; zudem konnte die Erkrankungsentwicklung bei prädiabetischen Tieren verhindert werden. Mechanistisch deuten diese Resultate darauf hin, dass sowohl zentrale als auch periphere Toleranzmechanismen beteiligt sind: die Präsenz spenderischer antigenpräsentierender Zellen in Kombination mit einer veränderten Thymusbildung und der Induktion regulatorischer T‑Zellen kann eine dauerhafte, donor‑spezifische Unempfindlichkeit fördern.
Wesentliche Ergebnisse und wissenschaftliche Bedeutung
Die Ergebnisse sind bemerkenswert: Die Therapie verhinderte Diabetes in hochriskanten Mäusemodellen und kehrte die Krankheit in Tieren mit vollem Krankheitsbild wieder um. Erheblich ist, dass während des Beobachtungszeitraums keine der behandelten Tiere eine Graft‑versus‑Host‑Erkrankung entwickelte und die allgemeine Immunfunktion, abgesehen von der Toleranz gegenüber den Spenderislets, weitgehend normal blieb. In einer kleinen Teilmenge der Inselzellen wurde eine leichte Entzündungsreaktion festgestellt, doch diese führte nicht zur Zerstörung der Zellen — ein ermutigendes Zeichen, dass toleranzspezifische Mechanismen am Werk sind und nicht eine pauschale Unterdrückung des Immunsystems.
Der leitende Autor Seung Kim von Stanford bezeichnete den Ansatz als potenziell transformierend und schlug vor, dass ähnliche hybride Strategien auf andere Autoimmunerkrankungen und soliden Organtransplantationen übertragbar sein könnten. Die Idee, Spender‑ und Empfängerimmunsysteme zu mischen, um Toleranz zu induzieren, ist nicht völlig neu — frühere Transplantationsstudien, einschließlich früherer Arbeiten derselben Gruppe, haben das Prinzip bereits demonstriert — doch die Anwendung auf Typ‑1‑Diabetes und die kombinierte Einsetzung von Inselersatz und hämatopoetischer Chimärismus‑Induktion stellt einen wichtigen Fortschritt dar. Wissenschaftlich öffnet dies Wege zur Erforschung antigen‑spezifischer Toleranz, zur Charakterisierung der Rolle regulatorischer T‑Zellen und zur Verbesserung der Langzeitstabilität transplantierter Inselzellen.
Herausforderungen voraus: Versorgung, Skalierung und Translation in den Menschen
Trotz der vielversprechenden Ergebnisse bestehen erhebliche Hürden, bevor menschliche Patienten profitieren können. Gespendete menschliche Inselzellen sind selten und in der Regel nur postmortal verfügbar; für das hybride Konzept wären klinische Protokolle erforderlich, die neben den Inseln auch passende hämatopoetische Stammzellen des Spenders vorsehen. Dies stellt logistische und immunologische Herausforderungen, etwa bei der HLA‑Typisierung und der strategischen Auswahl kompatibler Spender, die sowohl Inseln als auch Stammzellen liefern können. Parallel arbeiten Forscher daran, die Überlebensraten gespendeter Zellen zu erhöhen und zu prüfen, inwieweit Inseln aus pluripotenten Stammzellen (iPS‑ oder embryonalen Stammzellen) im Labor differenziert werden können, um eine zuverlässige, skalierbare Versorgungsquelle zu schaffen.
Weitere offene Fragen betreffen die optimale Anzahl an Spenderstammzellen und Inselzellen, das genaue Konditionierungsregime, das Wirksamkeit und Sicherheit ausbalanciert, sowie die langfristige Stabilität der induzierten Toleranz. Insbesondere muss das Risiko kurz‑ und langfristiger Nebenwirkungen der Konditionierung minimiert werden — hierzu gehören mögliche Infektionen, Organtoxizitäten oder andere therapieassoziierte Komplikationen. Das Team weist darauf hin, dass viele der klinischen Kernschritte, die zur Erzeugung hybrider Immunsysteme nötig sind, bereits in anderen medizinischen Kontexten eingesetzt werden (beispielsweise bei bestimmten allogenen Knochenmarktransplantationen zur Toleranzinduktion), was die Entwicklung von klinischen Prüfungen für Menschen mit Typ‑1‑Diabetes beschleunigen könnte. Dennoch sind robuste präklinische Sicherheitsdaten, standardisierte GMP‑Produkte und belastbare Zulassungsstrategien nötig, um die Translation verantwortungsvoll voranzubringen.
Fachliche Einordnung
„Die doppelte Strategie, verlorene Betazellen zu ersetzen und gleichzeitig das Immunsystem neu zu ‚erziehen‘, geht beide Seiten des Problems an“, erklärt Dr. Laura Chen, Immunologin und Transplantationsforscherin, die nicht an der Studie beteiligt war. „Wenn der hybride immunologische Zustand beim Menschen dauerhaft hält, könnte dies den Bedarf an chronischer Immunsuppression deutlich reduzieren oder sogar eliminieren — ein enormer klinischer Vorteil.“ Ihre Einschätzung unterstreicht die potenzielle Relevanz für Patienten: eine dauerhafte, antigen‑spezifische Toleranz würde nicht nur die Lebensqualität verbessern, sondern auch die langfristigen Risiken, die mit ständiger Immunsuppression verbunden sind, verringern.
Die Autoren bleiben vorsichtig optimistisch. Sie betonen, dass die Ergebnisse noch nicht direkt auf Menschen übertragbar sind, aber das mechanistische Konzept — kontrollierte Chimärismusbildung zur Induktion antigen‑spezifischer Toleranz — bereits in der klinischen Praxis für andere Indikationen vorhanden ist. Mit weiterer Optimierung der Konditionierungsprotokolle, der Entwicklung skalierbarer Zellproduktionsprozesse und einer vergleichenden Evaluierung verschiedener Stammzellquellen könnte dieser hybride Ansatz die Perspektive auf Autoimmunerkrankungen und zellbasierte Therapien nachhaltig verändern. Zu den nächsten Schritten gehören erweiterte präklinische Sicherheitsstudien, Studien zur Langzeitstabilität und die Entwicklung von Kriterien für die Auswahl geeigneter Patientenpopulationen.
Vorerst stellt die Forschung einen bedeutsamen Fortschritt dar: ein Laborbeweis, dass Autoimmunität und Zellersatz gleichzeitig adressiert werden können. Der Weg zu klinischen Studien am Menschen wird noch logistische, immunologische und regulatorische Fragen klären müssen, doch die Aussicht auf eine potenziell kurative Strategie für Typ‑1‑Diabetes ist damit deutlich näher gerückt. Weiterführende Arbeiten werden auch klären müssen, wie dieses Konzept mit anderen innovativen Ansätzen, etwa implantierbaren Insel‑Encapsulation‑Technologien oder immunmodulatorischen Vektorstrategien, kombiniert werden kann, um die Therapie weiter zu verbessern und breiter verfügbar zu machen.
Quelle: sciencealert

Kommentar hinterlassen