8 Minuten
Wissenschaftler haben eine einzelne Genvariante als Auslöser für eine außerordentlich seltene Form von Diabetes bei Neugeborenen identifiziert – eine Entdeckung, die neues Licht darauf wirft, wie insulinproduzierende Beta-Zellen entstehen, funktionieren und versagen. Die Mutation deaktiviert Beta-Zellen und kann zu ihrem Absterben führen, was eine besorgniserregende Dreierkombination von Symptomen bei betroffenen Säuglingen erklärt.
Ein Gen, ein verheerendes Kindersyndrom
Ein internationales Forschungsteam hat den neonatalen Diabetes bei sechs Säuglingen auf Mutationen im TMEM167A-Gen zurückgeführt. Diese Kinder zeigten zudem Mikrozephalie (eine ungewöhnlich kleine Kopfumfangsgröße) und in fünf von sechs Fällen Epilepsie – ein Merkmalsbündel, das bereits als MEDS (microcephaly, epilepsy, and diabetes syndrome) bekannt ist. Bislang waren nur zwei Gene (IER3IP1 und YIPF5) eindeutig mit MEDS verknüpft; die neuen Ergebnisse etablieren TMEM167A als dritte genetische Ursache und erweitern damit das genetische Spektrum dieser seltenen Syndrome.
Die Identifizierung von TMEM167A als Krankheitsgen hilft nicht nur beim Verstehen der Pathogenese einzelner Familienfälle, sondern liefert auch wichtige Hinweise auf gemeinsame molekulare Mechanismen, die sowohl die Entwicklung des zentralen Nervensystems als auch die Funktion des Pankreas betreffen. Da TMEM167A in Gehirn und Pankreas exprimiert wird, erklärt dies die gleichzeitige Schädigung beider Organsysteme bei betroffenen Patienten. Für Ärzte und genetische Berater bedeutet die Entdeckung, dass Familien mit entsprechenden klinischen Anzeichen künftig gezielter genetisch getestet und beraten werden können.
Wie TMEM167A die Insulinproduktion untergräbt
TMEM167A wird sowohl im menschlichen als auch im murinen Pankreas und Gehirn exprimiert – eine Verteilung, die plausibel macht, warum Mutationen Organfunktionen in beiden Systemen beeinträchtigen. Um die Auswirkungen der Mutation experimentell zu untersuchen, nutzten die Forscher gentechnische Methoden an humanen pluripotenten Stammzellen: Sie ersetzten das normale TMEM167A-Gen durch die Variante, die in einem MEDS-Patienten gefunden wurde. Diese Stammzellen wurden anschließend schrittweise in Richtung pankreatischer Vorläufer und schließlich in insulinproduzierende Beta-Zellen differenziert.
Die in vitro-Differenzierung menschlicher Stammzellen zu Beta-Zellen ist heute ein etabliertes Modell, um zelluläre Defekte zu analysieren, die in Patienten nicht leicht zugänglich sind. In diesem Fall ermöglichten kombinierte Ansätze aus Geneditierung (beispielsweise CRISPR/Cas9-gestützte Methoden), Expressionsanalysen und Funktionsprüfungen (wie der Glukose-stimulierten Insulinsekretionsassay) ein detailliertes Bild davon, wie die TMEM167A-Variante die zelluläre Physiologie beeinflusst. Analysen der Genexpression und Proteinmarker zeigten Auffälligkeiten in Signalwegen, die mit der Proteinfaltung und dem intrazellulären Transport zusammenhängen.
Entwicklung scheint normal – Funktion ist gestört
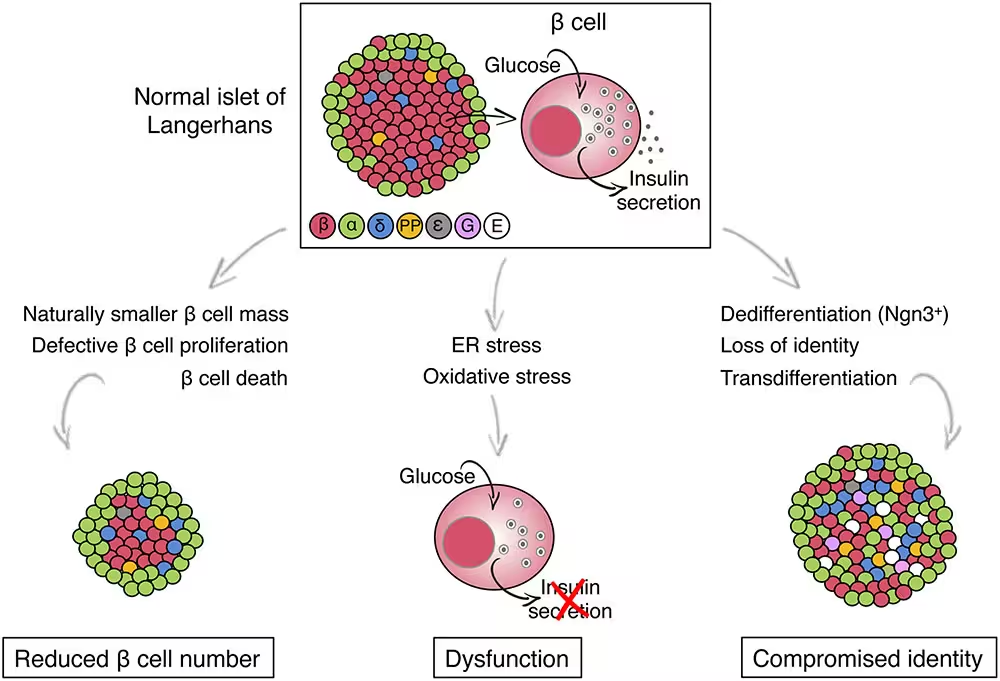
Überraschenderweise bildeten sich Beta-Zellen mit der TMEM167A-Variante offenbar in Form und Anzahl vergleichbar zu Kontrollzellen; morphologisch erschienen sie weitgehend normal. Funktionell waren diese Zellen jedoch deutlich beeinträchtigt: Bei Glukose-Stimulation gaben sie nicht ausreichend Insulin frei, wie es bei gesunden Beta-Zellen zu erwarten wäre. Die fehlende Insulinsekretion deutet darauf hin, dass das Problem nicht primär in der Differenzierung oder der Insulinbiosynthese liegt, sondern in nachgelagerten Prozessen der Verpackung, des Transports oder der Ausschüttung.
Die beobachtete Fehlfunktion wurde auf Stress im endoplasmatischen Retikulum (ER) zurückgeführt – dem zellulären Kompartiment, das für Proteinfaltung, Qualitätskontrolle und sekretorischen Transport verantwortlich ist. Anhaltender ER-Stress aktiviert in der Regel die sogenannte Unfolded Protein Response (UPR), bestehend aus Signalwegen wie PERK, IRE1 und ATF6, die kurzfristig protektive Effekte haben können. Wird der Stress jedoch chronisch, führt die dauerhafte Aktivierung dieser Pfade häufig zu pro-apoptotischen Signalen und schließlich zum Zelltod. In den untersuchten Beta-Zellen führten persistierende ER-Stress-Signale offenbar zu einem Funktionsverlust und zur Aktivierung von Mechanismen, die den Zelltod einleiten.
„Die Fähigkeit, insulinproduzierende Zellen aus Stammzellen zu erzeugen, hat es uns ermöglicht, genau das zu untersuchen, was bei Beta-Zellen von Patienten mit seltenen Formen sowie anderen Typen von Diabetes fehlreguliert ist“, erklärte die Diabetologin Miriam Cnop von der Vrije Universiteit Brussel (Free University of Brussels). „Dieses Modell ist außergewöhnlich geeignet, Krankheitsmechanismen zu studieren und mögliche Behandlungsansätze zu testen.“
Warum das über seltene Erkrankungen hinaus wichtig ist
Auch wenn MEDS extrem selten ist (vor dieser Studie waren nur etwa elf Fälle dokumentiert), spiegeln die zellulären Probleme – ER-Stress, ausgefallene Insulinsekretion und Verlust von Beta-Zellen – Mechanismen wider, die auch bei häufigeren Diabetesformen eine Rolle spielen, etwa beim Typ-2-Diabetes. In der Pathophysiologie des Typ-2-Diabetes tragen ER-Stress und eine gestörte Insulinsekretion bereits nachweislich zur Progression der Erkrankung bei: Fehlgefaltete Proteine, Überlastung des sekretorischen Systems und chronische Stressantworten können letztlich die Beta-Zellmasse reduzieren und die Glykämiekontrolle verschlechtern.
Die Überschneidung dieser fundamentalen zellulären Mechanismen bedeutet, dass Erkenntnisse aus der Untersuchung seltener monogener Erkrankungen wie jener durch TMEM167A-Mutationen auf größere Patientengruppen übertragbar sein können. Genetische „Sonderfälle“ erlauben es Forschern, Schlüsselfaktoren für die Insulinsekretion und Zellresilienz zu identifizieren, die sonst in komplexen multifaktoriellen Erkrankungen schwer zu isolieren wären. Dadurch eröffnen sich potenzielle Forschungsfelder für Wirkstoffziele, Biomarkerentwicklung und die Optimierung von Stammzell-basierten Ersatztherapien.
„Die Entdeckung der DNA-Veränderungen, die Diabetes bei Säuglingen verursachen, bietet uns einen einzigartigen Weg, Gene zu finden, die eine zentrale Rolle bei der Bildung und Sekretion von Insulin spielen“, meinte die molekulargenetische Forscherin Elisa de Franco von der University of Exeter. „Unsere Arbeit macht deutlich, wie wichtig ein bisher wenig beachtetes Gen wie TMEM167A für die Insulinsekretion ist.“
Methodisch liefert die Studie auch ein Beispiel dafür, wie moderne Stammzell- und Geneditiertechniken kombiniert werden können, um Krankheitsmechanismen auf zellulärer Ebene zu entschlüsseln. Solche integrativen Ansätze sind besonders wertvoll für die Erforschung genetischer Varianten mit pleiotropen Effekten – also solchen, die mehrere Organsysteme beeinflussen, wie in diesem Fall Gehirn und Pankreas.
Blick nach vorn: Diagnostik und potenzielle Therapien
Auf klinischer Ebene ermöglicht die Kenntnis über TMEM167A-Mutationen eine eindeutige genetische Diagnose von MEDS-Fällen, was für die neonatale Versorgung, spezialisierte Betreuung und genetische Beratung der Familien von großer Bedeutung ist. Durch präzise Genotypisierung lassen sich Prognoseabschätzungen verbessern und spezifische Unterstützungsmaßnahmen frühzeitig einleiten. Zudem kann die Integration des TMEM167A-Gens in molekulargenetische Panels für neonatalen Diabetes die Erkennungsrate erhöhen.
Auf der Forschungsebene bietet das Stammzellmodell einen Testboden für Substanzen, die ER-Stress reduzieren oder die Insulinsekretion stärken könnten. In präklinischen Tests werden häufig chemische Chaperone wie 4-Phenylbutyrat (4-PBA) oder Tauroursodeoxycholsäure (TUDCA) erprobt, die die Proteinfaltung unterstützen und ER-Stress dämpfen können. Solche Substanzen könnten, theoretisch, die Belastung im sekretorischen Apparat der Beta-Zellen reduzieren und so Funktionsverlust und Zelltod verlangsamen. Darüber hinaus eröffnen Hochdurchsatz-Screenings mit Stammzell-abgeleiteten Beta-Zellen die Möglichkeit, bereits zugelassene Wirkstoffe (Drug repurposing) als Kandidaten für eine schnellere klinische Erprobung zu identifizieren.
Gen- oder RNA-basierte Therapien, die direkt auf die gebaute Genvariante abzielen, sind ein weiterer denkbarer, aber komplexerer Weg. Die Entwicklung solcher Therapien würde umfangreiche Sicherheits- und Wirksamkeitsprüfungen benötigen und ist eher mittelfristig zu sehen. Inzwischen sind konservative Strategien plausibler, die sich darauf konzentrieren, ER-Stress-Mechanismen zu modulieren, die UPR anzupassen oder die zelluläre Proteostasis zu stärken.
Wichtig ist zudem die translational orientierte Verbesserung von Stammzell-basierten Beta-Zell-Ersatztherapien: Ein besseres Verständnis molekularer Schwachstellen, etwa durch TMEM167A-Mutationen, erlaubt es, differenzierte Zellen so zu optimieren, dass sie robuster gegenüber Stress werden. Das könnte die langfristige Funktion von transplantierten Zellen verbessern und somit Therapien für Patienten mit Beta-Zell-Insuffizienz – einschließlich bestimmter Formen des Typ-1- und Typ-2-Diabetes – voranbringen.
Obwohl therapeutische Anwendungen noch Jahre an Forschung, präklinischen Studien und klinischen Prüfungen erfordern, öffnet die Studie einen direkten Pfad von der Genentdeckung zur mechanistischen Einsicht – und schlussendlich zu gezielten Interventionen, die sowohl seltene monogene Erkrankungen als auch häufigere diabetische Krankheitsbilder betreffen könnten.
Abschließend ist zu betonen, dass weitere Forschung notwendig ist, um die genauen molekularen Funktionen von TMEM167A vollständig zu beschreiben, mögliche Interaktionspartner zu identifizieren und den Beitrag verschiedener Mutationsarten an Krankheitsschwere und Phänotypen zu klären. Interdisziplinäre Zusammenarbeit zwischen Genetikern, Zellbiologen, Diabetologen und klinischen Betreuern wird entscheidend sein, um diese Erkenntnisse erfolgreich in diagnostische und therapeutische Konzepte zu überführen.
Quelle: sciencealert

Kommentar hinterlassen