8 Minuten
Ingenieure bauen ein künstliches Neuron, das die elektrische Sprache des Gehirns spricht
Forscherinnen und Forscher der University of Massachusetts Amherst haben ein künstliches Neuron entwickelt, das aus Protein-Nanodrähten besteht und bei Spannungen arbeitet, die mit denen biologischer Neuronen vergleichbar sind. Die Struktur basiert auf Proteinfilamenten, die von dem elektrizitätsproduzierenden Bakterium Geobacter sulfurreducens synthetisiert werden. Das Gerät registriert und erzeugt Signale bei etwa 0,1 Volt – also im selben Spannungsbereich wie menschliche Nervenzellen. Diese Niederspannung eröffnet Wege zu energieeffizienten neuromorphen Systemen und zu direkten elektronischen Schnittstellen mit lebendem Gewebe.
Wissenschaftlicher Hintergrund und technische Details
Biologische Neuronen übertragen Informationen über kleine Spannungsänderungen an ihren Membranen: Ruhepotenziale, synaptische Potentiale und Aktionspotenziale arbeiten typischerweise im Millivolt- bis niedrigen Volt-Bereich. Ein Paradebeispiel ist das menschliche Gehirn, das komplexe kognitive Aufgaben mit einer erstaunlich geringen Leistungsaufnahme von rund 20 Watt ausführt. Das steht in krassem Gegensatz zu vielen modernen künstlichen-intelligenz-Systemen, die für vergleichbare oder sogar deutlich weniger spezialisierte Aufgaben deutlich höhere Energiemengen benötigen. Aus diesem Grund streben Ingenieurinnen und Ingenieure seit langem danach, künstliche Neuronen zu entwerfen, die biologische Funktionen nachahmen: Das Ziel ist sowohl höhere Energieeffizienz als auch bessere Kompatibilität für die Interaktion mit lebenden Systemen.
Viele vorherige Implementierungen künstlicher Neuronen benötigten höhere Spannungen und damit deutlich mehr Energie. Nach Angaben von Jun Yao, Associate Professor für Elektrotechnik und Computertechnik an der UMass Amherst und Seniorautor der veröffentlichten Studie, lagen frühere Designs oft bei etwa dem Zehnfachen der Spannung und verbrauchten bis zu hundertmal mehr Leistung als das neue Protein-Nanodraht-Neuron. Wenn ein künstliches Neuron nahe 0,1 V arbeitet, wird es kompatibel mit lebendem Nervengewebe und reduziert die Komplexität von Schaltungen, weil große Verstärkerstufen entfallen. Das bedeutet weniger Bauteile, geringere Verluste und insgesamt sparsamere Systeme.
Das Basismaterial ist ein Protein-Nanodraht, gewonnen aus Geobacter sulfurreducens, einem Bakterium, das für die Produktion leitfähiger Proteinfilamente bekannt ist. Das UMass-Team hat diese biologischen Nanodrähte bereits zuvor in verschiedenen Anwendungen untersucht: energieeffiziente Biosensoren, schweißbetriebene Biofilme für tragbare Elektronik und Vorrichtungen zur Stromerzeugung aus Luftfeuchtigkeit sind einige Beispiele. In der aktuellen Arbeit bilden die Protein-Nanodrähte das aktive Element eines synthetischen Neurons, das sowohl Spannungssignale empfangen als auch in einem biologisch relevanten Bereich aussenden kann. Diese Fähigkeit, elektrische Signale in der Größenordnung biologischer Neuronen zu verarbeiten, ist eine Schlüsselanforderung für hybride Bio‑Elektronikschnittstellen.
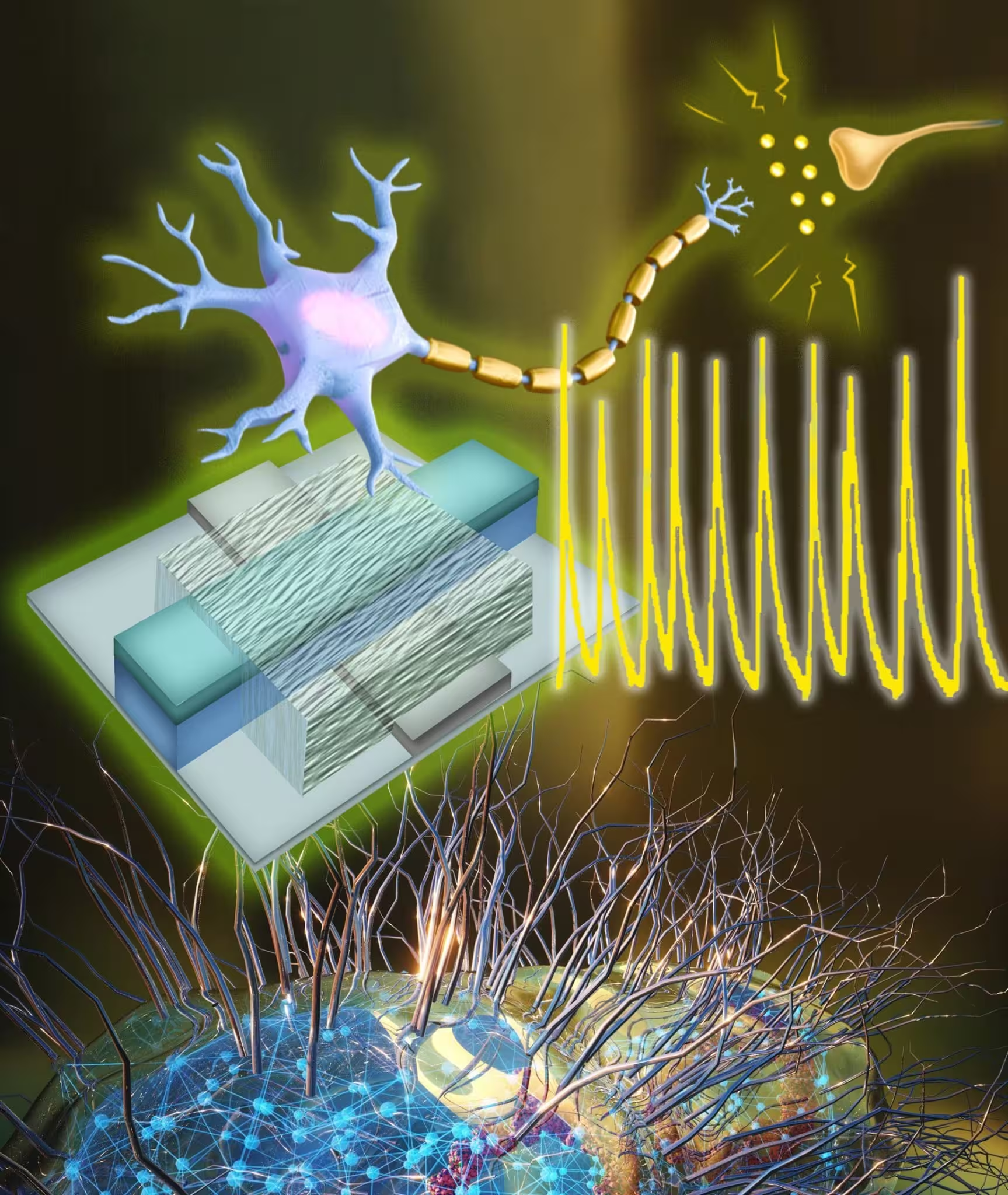
Wesentliche Erkenntnisse und praktische Bedeutung
Erstautor Shuai Fu, Doktorand in Elektrotechnik und Computertechnik, hob die Effizienzgewinne hervor: „Unser Gehirn verarbeitet enorme Datenmengen, verbraucht dabei aber sehr wenig Energie,“ sagte er und verglich damit die biologische Verarbeitung mit den hohen Energiekosten großer Sprachmodelle und datenintensiver KI-Systeme. Das neue künstliche Neuron zeigt, dass proteinbasierte Elektronik Spannungsamplituden erreichen kann, die mit lebenden Neuronen vergleichbar sind. Das ist ein wesentlicher Schritt in Richtung hybrider bio-elektronischer Systeme, die ohne große Transformations- oder Verstärkungsstufen direkt mit biologischen Signalen arbeiten.
Die praktischen Folgen sind vielfältig: Messbare Anwendungen umfassen die nächste Generation tragbarer Sensoren, implantierbare Geräte zur direkten Kommunikation mit dem Nervensystem sowie vereinfachte Messketten, die ohne sperrige Verstärker und Signalaufbereitungen auskommen. Aktuelle Wearables detektieren oft biologische Signale, die für Standardelektronik zu schwach sind; dadurch sind zusätzliche Verstärker erforderlich, was Energiebedarf und Komplexität erhöht. Künftige Geräte, die auf niedrigspannigen künstlichen Neuronen basieren, könnten diese Verstärker umgehen, das Design vereinfachen und die Batterielaufzeit deutlich verlängern. Für implantierbare Neuroprothesen würde das bedeuten, dass Signale direkter, energieeffizienter und mit geringerem thermischen Fußabdruck übertragen werden könnten – ein Vorteil für Langzeitimplantate.
Darüber hinaus lassen sich die Auswirkungen auf die Systemarchitektur nicht unterschätzen: Wenn Bausteine von Grund auf auf biologische Spannungsbereiche zugeschnitten sind, können Schnittstellen zwischen Silizium‑Elektronik und biologischen Netzwerken schlanker und zuverlässiger gestaltet werden. Beispiele sind bidirektionale Schnittstellen, die sowohl Signale aus dem Nervensystem aufnehmen als auch passende elektrische Impulse zurückgeben, um etwa Prothesen zu steuern oder sensorische Informationen zu vermitteln. Solche Anwendungen erfordern präzise Zeitauflösung, niedrige Nebengeräusche und stabile Langzeitperformanz; proteinbasierte Bauelemente könnten hier neue Lösungsräume eröffnen.
Zugehörige Technologien und Perspektiven
Die Entwicklung liegt an der Schnittstelle mehrerer aktiver Forschungsgebiete: Neuromorphe Hardware (Geräte, die neuronale Architekturen nachbilden), Bioelektronik (Geräte, die mit biologischen Systemen interagieren) und synthetische Biologie (gezielte Nutzung oder Veränderung von Organismen beziehungsweise Biomolekülen für neue Funktionen). Durch die Integration von Protein‑Nanodrähten in Schaltungen lassen sich bioinspirierte Rechenarchitekturen entwerfen, die für spezialisierte Aufgaben wie sensorische Verarbeitung, Mustererkennung und Echtzeit-Eingangsfilterung weitaus effizienter sein könnten als konventionelle siliziumbasierte Lösungen.
Dennoch bestehen noch zentrale Herausforderungen: Langzeitstabilität unter physiologischen Bedingungen, umfassende Biokompatibilität, robuste Herstellungsverfahren und industrielle Skalierbarkeit der proteinbasierten Komponenten werden darüber entscheiden, ob diese künstlichen Neuronen vom Labor in klinische oder kommerzielle Anwendungen überführt werden können. Prozessfragen wie die Kontrolle von Reinheit und Leitfähigkeit, die Integration in bestehende Chipfertigungsprozesse und die Sicherstellung reproduzierbarer elektrisch‑mechanischer Eigenschaften sind technische Hürden. Außerdem muss geklärt werden, wie man große Netzwerke aus künstlichen Neuronen zuverlässig verdrahtet, synchronisiert und adressiert, ohne dabei Signalverluste oder Stabilitätsprobleme einzuführen.
Ein weiterer Forschungsbereich betrifft die Schnittstelle zu lebendem Gewebe: Sicherheitsfragen, Immunantworten, mögliche Degeneration der biologischen Komponente und langfristige Materialwechselwirkungen sind kritisch. Entwicklern stehen heute mehrere Strategien offen, darunter Oberflächenmodifikationen zur Verbesserung der Biokompatibilität, Einkapselungsschichten, die den direkten Kontakt kontrollieren, sowie adaptive Schaltungen, die sich an veränderliche biologische Parameter anpassen können. Parallel dazu erfordern regulatorische Pfade für implantierbare oder medizinisch genutzte Geräte fundierte toxikologische und biokompatibilitätsbezogene Studien, die Zeit und Ressourcen benötigen, bevor klinische Nutzung möglich wird.
Zukünftige Richtung und mögliche Anwendungen
Kurzfristig erscheinen Anwendungen wie extrem stromsparende Biosensoren, effizientere neural gesteuerte Prothesen und adaptive Wearables, die lokale Signale direkt vor Ort verarbeiten, besonders vielversprechend. Solche Systeme könnten zum Beispiel Gesundheitsüberwachung mit längerer Batterielaufzeit, präzisere Signalerfassung bei geringerem Rauschen und niedrigere Gesamtkosten durch einfachere Elektronik ermöglichen. Denkbar sind auch dezentrale Sensornetzwerke, die in der Lage sind, kontinuierlich physiologische Signale mit minimaler Energie einzusammeln und vorzuverarbeiten, bevor sie nur relevante Daten an eine Cloud oder ein mobiles Gerät senden.
Langfristig könnten Netzwerke aus Protein-Nanodraht-Neuronen die Grundlage für neuromorphe Prozessoren bilden, die hochparallele, spezialisierte Berechnungen mit deutlich geringerer Energieaufnahme als heutige, auf Silizium basierende Architekturen ausführen. Solche Prozessoren würden sich besonders für Aufgaben eignen, bei denen sensorische Eingaben in Echtzeit analysiert und klassifiziert werden müssen – etwa in autonomen Systemen, in der Robotik, bei adaptiven Steuerungen von Prothesen oder in Energiespar‑Edge‑Computing‑Geräten. Durch die native Verarbeitung von schwachen elektrischen Signalen könnten diese Systeme außerdem direkt mit biologischen Sensoren oder Neuronennetzen verbunden werden.
Ein konkretes Szenario: In einer Kombination aus proteinbasierten Neuronen und künstlicher Intelligenz könnten tragbare Gesundheitsgeräte nicht nur Rohdaten sammeln, sondern auch vor Ort Vorverarbeitung und einfache Klassifizierungen durchführen. Nur die relevanten, stark verdichteten Informationen würden dann an ein zentrales System übertragen – das spart Übertragungsenergie und erhöht die Privatsphäre, da sensible Rohdaten das Gerät möglicherweise nicht verlassen müssen. In klinischen Anwendungen könnten implantierbare Systeme peripheres Nervengewebe überwachen und in Echtzeit reagieren, ohne dass externe Verstärker oder große Energiequellen nötig wären.
Schlussfolgerung
Das Protein-Nanodraht-Neuron des UMass Amherst-Teams stellt einen wichtigen Fortschritt in Richtung energieeffizienter, biokompatibler Elektronik dar, die buchstäblich die Sprache des Gehirns spricht. Indem diese Geräte biologische Spannungsniveaus nachbilden, reduzieren sie die Notwendigkeit großer Verstärkerstufen und weisen den Weg zu einer engeren und natürlicheren Interaktion zwischen Rechenhardware und lebendem Gewebe. Der Übergang von Laborprototypen zu produktionsfähigen Lösungen wird von mehreren wissenschaftlichen, technischen und regulatorischen Fragen abhängen. Dennoch öffnen die Ergebnisse vielversprechende Perspektiven für neuromorphe Rechner, Schnittstellen für Neuroprothesen und eine neue Generation von Wearables und Implantaten, die lokal, effizient und sensorgerecht arbeiten.
Quelle: scitechdaily


Kommentar hinterlassen