8 Minuten
Forscher haben winzige Kunststoffpartikel — sogenannte Nanoplastikpartikel oder Nanoplastik — im menschlichen Gehirn nachgewiesen, und dieser Befund verändert die wissenschaftliche Betrachtung von Demenz. Erste Daten deuten darauf hin, dass diese Umweltkontaminanten bei Menschen mit kognitivem Abbau häufiger vorkommen, was eine Neubewertung der biologischen Signalwege hinter Alzheimer, vaskulärer Demenz und anderen Formen neurodegenerativer Erkrankungen erzwingt. Die Entdeckung verknüpft Umwelttoxikologie, Neuropathologie und klinische Forschung und erweitert die Diskussion über Ursachen, Risikofaktoren und Präventionsstrategien im Bereich der Demenzforschung.
Why this discovery matters
Über Jahrzehnte hinweg konzentrierte sich die Demenzforschung auf charakteristische Proteine wie Amyloid-beta und Tau, auf Gefäßschäden im Gehirn sowie auf genetische Risikofaktoren. Der Nachweis, dass Kunststoffpartikel tatsächlich Gehirngewebe erreichen können, fügt dieser Forschung ein neues Element hinzu. Leitende Wissenschaftler bezeichnen Nanoplastik als "einen neuen Faktor" in der Pathologie des Gehirns. Vorläufige Vergleiche zeigen offenbar höhere Konzentrationen dieser Partikel in Proben von Personen mit diagnostizierter Demenz im Vergleich zu kognitiv normalen Kontrollen. Diese Korrelation beweist zwar noch keine Kausalität, wirft aber dringliche Fragen auf: Tragen Nanoplastikpartikel aktiv zur Auslösung oder Beschleunigung von Neurodegeneration bei, oder sammeln sie sich sekundär in bereits geschädigtem Gewebe an?
Die Bedeutung dieser Fragestellung liegt in den weitreichenden Konsequenzen: Falls Nanoplastik ursächlich beteiligt ist, würde dies nicht nur das Verständnis pathophysiologischer Mechanismen verändern, sondern auch präventive Maßnahmen, Regulierung von Plastikemissionen und klinische Behandlungsansätze beeinflussen. Selbst wenn Nanoplastik lediglich ein Biomarker für andere schädigende Prozesse wäre, könnte die Verfolgung seiner Verteilung Hinweise auf zugrundeliegende vaskuläre oder inflammatorische Mechanismen liefern. Kurz gesagt: Die Beobachtung erweitert Hypothesen zu Demenzursachen und eröffnet neue Forschungsrichtungen in Neuropathologie, Umweltmedizin und öffentlicher Gesundheit.
What the science says so far
Nanoplastik entsteht größtenteils durch den Zerfall größerer Kunststoffteile (Mikro- und Makroplastik) sowie durch direkte Emissionen aus industriellen Quellen, Kosmetika, Textilabrieb und Abwasser. Chemisch bestehen diese Partikel aus verschiedenen Polymertypen — etwa Polyethylen (PE), Polypropylen (PP), Polyethylenterephthalat (PET) oder Polystyrol (PS) — und können Additive sowie gebundene Schadstoffe wie Weichmacher (Phthalate) oder persistente organische Schadstoffe transportieren. Aufgrund ihrer geringen Größe (unter einem Mikrometer bis wenige Nanometer) gelangen Nanopartikel leichter in biologische Systeme: Sie können sich im Blut verteilen, Barrieren überwinden und potentiell die Blut-Hirn-Schranke passieren oder an Gefäßwänden haften.
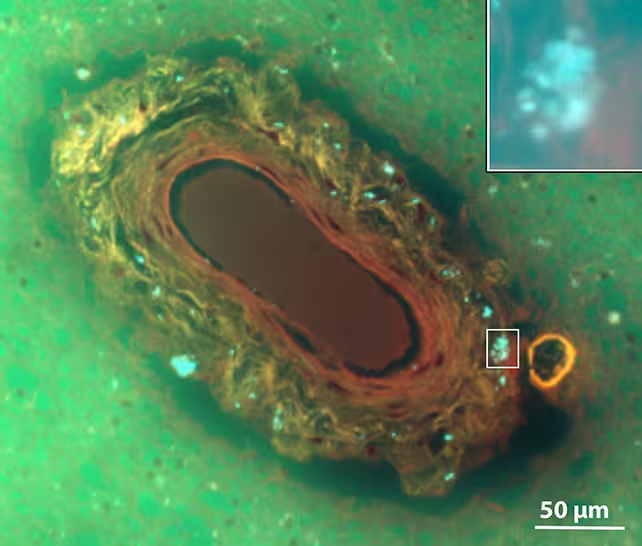
Pathologische Berichte und experimentelle Studien legen nahe, dass Nanoplastik im Gewebe akkumulieren kann. Es existieren erste Untersuchungen an postmortalen Gehirnproben, in denen mittels hochauflösender Mikroskopie und spektrometrischer Analysen Nanoplastik nachgewiesen wurde. Forscher beobachten bestimmte Muster: Höhere Partikellasten scheinen mit bestimmten Demenzsubtypen sowie mit dem Schweregrad der Erkrankung zu korrelieren. Diese Muster sind noch nicht vollständig erklärt, deuten aber darauf hin, dass die Partikel entzündliche Reaktionen, Endothelverletzungen in Blutgefäßen oder zellulären Stress auslösen bzw. verstärken könnten — Mechanismen, die bereits mit kognitivem Abbau und neurodegenerativen Prozessen in Verbindung gebracht werden.
Experimentelle Modelle, etwa In-vitro-Studien mit neuronalen und glialen Zelllinien sowie Tiermodelle, zeigen, dass Nanopartikel oxidative Stressreaktionen, proinflammatorische Zytokinfreisetzung und Störungen der Mitochondrienfunktion auslösen können. Zudem gibt es Hinweise darauf, dass Nanoplastik die Integrität der Blut-Hirn-Schranke beeinflussen kann, zum Beispiel durch Schädigung von Endothelzellen oder durch Veränderungen im Tight-Junction-Komplex. Solche Effekte könnten den Eintritt weiterer Schadstoffe oder immunologischer Prozesse ins Gehirn erleichtern und damit neurodegenerative Entwicklungen begünstigen.
Wissenschaftliche Unsicherheiten bleiben groß: Unterschiede in Partikelgröße, Form (z. B. sphärisch vs. faserförmig), chemischer Zusammensetzung und Oberflächenmodifikationen beeinflussen biologische Wechselwirkungen stark. Ebenso ist die Frage offen, ob die beobachteten Konzentrationen in menschlichen Geweben funktionell relevant sind — also in welchem Maße sie Zellfunktionen nachhaltig verändern können. Deshalb fordern Forscher gut kontrollierte, groß angelegte Studien mit standardisierten Nachweismethoden, detaillierter Charakterisierung von Partikeleigenschaften und klar definierten klinischen Daten, um belastbare Aussagen zur Bedeutung von Nanoplastik für Demenzrisiken treffen zu können.
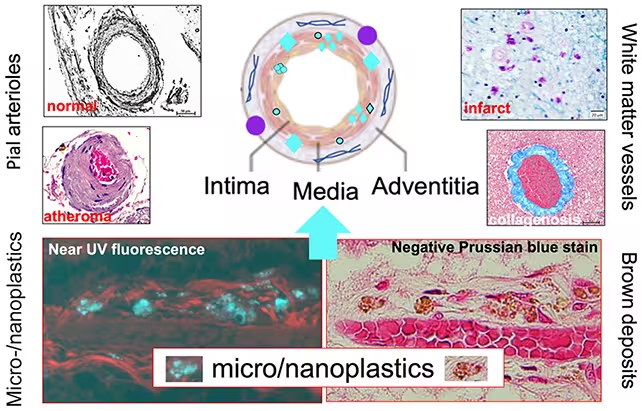
Vascular dementia gets re-examined
Vaskuläre Beiträge zu kognitiver Beeinträchtigung sind seit dem späten 19. Jahrhundert bekannt: Schlaganfälle, chronische Mikroangiopathien und Gefäßveränderungen zählen zu etablierten Ursachen vaskulärer Demenz. In den letzten Jahrzehnten richtete die Diagnostik und Forschung jedoch oft den Fokus auf proteinopathische Prozesse wie Amyloid- und Tau-Ablagerungen, wodurch vaskuläre Mechanismen teilweise in den Hintergrund traten. Der Nachweis von Nanoplastik in Gehirngefäßen und Parenchym bietet nun einen neuen Rahmen, um Unterschiede zwischen Demenztypen zu vergleichen und zu hinterfragen, warum manche Patienten besonders anfällig für vaskuläre Hirnschäden sind.
Nanoplastik könnte vaskuläre Pathologien auf mehrere Arten beeinflussen: direkte mechanische Interaktion mit Endothelzellen, Induktion von Endotheliitis oder Thromboseförderung durch Oberflächenadsorption von Blutproteinen. Ferner könnten plastikgebundene Schadstoffe wie Schwermetalle oder organische Toxine die Gefäßfunktionen zusätzlich stören. Dies würde erklären, warum bei bestimmten Patientengruppen — etwa mit vaskulären Risikofaktoren wie Hypertonie, Diabetes oder arterieller Verkalkung — eine höhere Partikellast besonders schädlich wirkt.
Die Neubewertung vaskulärer Faktoren bedeutet auch, dass bildgebende Verfahren (MRT, Gefäßdarstellungen) und neuropathologische Untersuchungen stärker integriert werden müssen, um Muster von Partikelverteilung, Gefäßschäden und neuronaler Degeneration in Beziehung zu setzen. Solche integrativen Ansätze können helfen, die heterogene Natur von Demenz zu erklären und personalisierte Präventions- oder Behandlungsstrategien zu entwickeln.
Implications for research and public health
Falls Nanoplastik eine aktive Rolle bei der Neurodegeneration spielt, hätte das weitreichende Auswirkungen auf Präventionsstrategien, Umweltregulierung und klinische Versorgung. Präventive Maßnahmen könnten emissions- und abfallbezogene Regulierung verstärken, die Verwendung bestimmter Polymertypen einschränken oder Maßnahmen zur Reduktion von Partikelemissionen aus Industrie, Textilien und Abwasser verbessern. Öffentlichkeitsarbeit zur Minimierung der persönlichen Exposition (z. B. durch Trinkwasseraufbereitung, Lebensmittelverpackungen oder Atemschutz in hoch belasteten Umgebungen) könnte ebenfalls an Relevanz gewinnen.
Für die Forschung bedeutet dies einen klaren Bedarf an größeren, multizentrischen Studien, die Partikeltypen systematisch kartieren, Eintrittswege (Inhalation, orale Aufnahme, transdermale Aufnahme) analysieren und biologische Effekte in menschlichem Gewebe sowie Tier- und Zellmodellen quantifizieren. Methodische Standardisierung ist entscheidend: vergleichbare Probenaufbereitung, Validierung von Nachweismethoden (z. B. Raman-Spektroskopie, Massenspektrometrie, Elektronenmikroskopie) und transparente Berichtsstandards würden die Nachvollziehbarkeit und Vergleichbarkeit von Studien verbessern.
Aus der Perspektive der öffentlichen Gesundheit ist interdisziplinäre Zusammenarbeit unerlässlich: Pathologie, Toxikologie, Neurologie, Epidemiologie und Umweltwissenschaften müssen Daten und Methoden vereinheitlichen, um Ursache-Wirkungs-Beziehungen zu untersuchen. Gleichzeitig sind gesundheitspolitische Entscheidungen oft von einem Evidenzgrad abhängig, der politisches Handeln erschwert. Dennoch können präventive Prinzipien wie Schadstoffreduktion, sorgsame Regulierung von Kunststoffherstellung und -entsorgung sowie Investitionen in Forschungsinfrastruktur sinnvolle erste Schritte sein.
Darüber hinaus sollten Kliniker und Gerontologen sensibilisiert werden: Bei Patienten mit kognitiven Symptomen lohnt sich künftig eventuell die Berücksichtigung umweltmedizinischer Expositionsdaten in der Anamnese. Langfristig könnten Biomarker für Nanoplastik im Blut oder Liquor entwickelt werden, die als ergänzende Indikatoren für Expositionen dienen. Solche Marker könnten helfen, Risikogruppen zu identifizieren und Präventionsmaßnahmen gezielter einzusetzen.
What comes next
Die nächsten Forschungsschritte müssen mehrere Fragen gleichzeitig adressieren: Welche Partikelarten finden sich im menschlichen Gehirn (Polymertyp, Größe, Form)? Durch welche Routen gelangen sie dorthin? Welche biologischen Prozesse werden in Zellen und Gefäßen moduliert? Und schließlich: Führt die Reduktion von Umweltbelastungen tatsächlich zu einem geringeren Gewebebelastungsgrad bzw. zu messbaren klinischen Vorteilen?
Interventionsstudien könnten untersuchen, ob Maßnahmen zur Reduktion der individuellen Exposition (z. B. Filterung von Trinkwasser, Verringerung von Plastikverpackungen, arbeitsplatzbezogene Schutzmaßnahmen) die Biomarkerlast im Blut und möglicherweise im Liquor reduzieren. Parallel dazu sind therapeutische Ansätze denkbar, die die zellulären Reparaturmechanismen stärken, Entzündungen dämpfen oder vaskuläre Integrität fördern, um Partikel-assoziierte Schäden zu kompensieren. Solche Strategien müssen jedoch auf einer soliden Grundlagenforschung aufbauen, die Mechanismen und Dosis-Wirkungs-Beziehungen klarer definiert.
Für die klinische Praxis bedeutet die Entdeckung vorerst vor allem eine Aufforderung zur Vorsicht: Demenz ist biologisch heterogener als lange angenommen, und Nanoplastik könnte ein Puzzlestück in diesem komplexen Bild sein. Klinische Leitlinien könnten zukünftig Empfehlungen für die Erfassung umweltbezogener Expositionen enthalten, und Forschungskonsortien könnten multidisziplinäre Studien fördern, die von epidemiologischen Beobachtungen bis zu molekularen Mechanismen reichen.
Zusammenfassend ist die Entdeckung von Nanoplastik im Gehirn kein abgeschlossener Befund mit sofortigen klinischen Konsequenzen, bietet aber eine wichtige neue Richtung für Forschung und öffentlichen Diskurs. Sie betont die Notwendigkeit, Umweltfaktoren stärker in das Verständnis neurodegenerativer Erkrankungen einzubeziehen und die Schnittstellen zwischen Umweltmedizin, Neurologie und Gesundheitswesen zu stärken.
Quelle: sciencealert

Kommentar hinterlassen