6 Minuten
Forscher haben einen überraschenden neuen Weg entdeckt, um insulinproduzierende Zellen zu erzeugen: durch die Reprogrammierung von menschlichem Magengewebe. Mithilfe im Labor gezüchteter Magen-Organoide und eines genetischen "Schalters" verwandelten Wissenschaftler Magenzellen in beta-ähnliche Zellen, die Insulin ausschütten und bei diabetischen Mäusen zur Blutzuckerkontrolle beitragen können. Diese Untersuchungen verbinden Konzepte aus der Regenerativen Medizin, Zellbiologie und Endokrinologie und eröffnen neue Perspektiven für die Behandlung von Typ-1-Diabetes.
From stomach organoids to insulin factories
Typ‑1‑Diabetes entsteht, wenn die Bauchspeicheldrüse die spezialisierten Betazellen verliert oder diese durch eine Autoimmunreaktion zerstört werden. Betroffene sind dadurch auf lebenslange Insulingaben, kontinuierliche Blutzuckerkontrollen und intensive Diabetes‑Managementprogramme angewiesen. Um diese verlorenen Betazellen zu ersetzen, haben Forscher verschiedene Strategien verfolgt — von Stammzell‑abgeleiteten Inseln (islets) bis zu Organ‑ und Zelltransplantationen von Spendern — doch jede Methode stößt auf Herausforderungen wie Immunabwehr, begrenzte Verfügbarkeit von Spendergewebe, aufwändige Produktion und regulatorische Hürden.
Das internationale Team unter Leitung von Xiaofeng Huang (Weill Cornell Medicine, USA) und Qing Xia (Peking University, China) verfolgte deshalb eine elegante Alternative: die Nutzung bereits im Körper vorhandener Zellen als Ausgangsmaterial. Aufbauend auf früheren Mausexperimenten züchteten die Forschenden miniaturisierte, dreidimensionale Modelle des menschlichen Magens, sogenannte Organoide, die wesentliche Merkmale des Magengewebes nachbilden. In diesen humanen Magen‑Organoiden etablierten sie ein programmierbares Set genetischer Faktoren — vereinfacht: einen Schalter — der, einmal aktiviert, die Magenzellen dazu bringen kann, eine beta‑ähnliche Identität zu übernehmen und Insulin zu produzieren. Diese Strategie verbindet Prinzipien der Zellreprogrammierung und des Tissue Engineering und nutzt die biologische Verwandtschaft zwischen endodermalen Zelltypen.
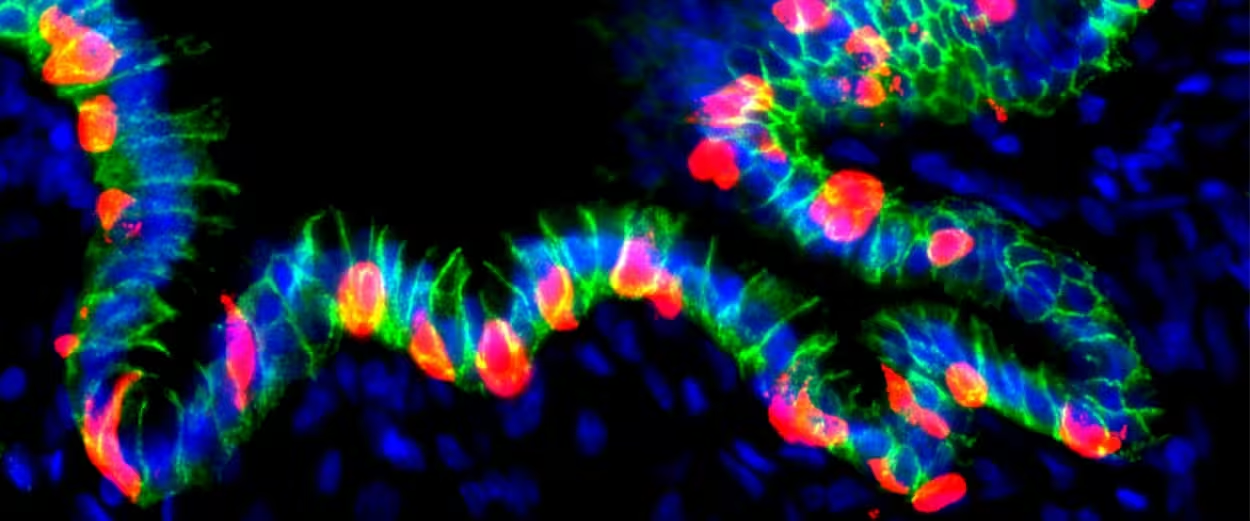
Grafted hGO-NPM generates insulin+ cells
How the reprogramming worked
- Das Team kultivierte humane Magen‑Organoide in vitro, um eine erneuerbare Zellquelle zu sichern.
- Sie statteten die Organoide mit einem kontrollierbaren genetischen Programm aus, das Betazellgene und die zugehörige Proteinsynthese aktiviert.
- Nach der Transplantation dieser gentechnisch veränderten Organoide in den Bauchraum von Mäusen integrierten sich die Gewebe in die lokale Gefäßversorgung und überdauerten Monate.
- Beim Aktivieren des Schalters begannen die human abgeleiteten Magenzellen Insulin zu produzieren und zeigten genetische sowie proteomische Marker, die mit denen pankreatischer Betazellen vergleichbar waren.
Why this matters for Type 1 diabetes
In Modellen mit diabetischen Mäusen verringerte das von den umprogrammierten menschlichen Magenzellen freigesetzte Insulin den Blutzucker und verbesserte klinische Parameter — ein zentraler Proof‑of‑Concept. Da Magengewebe über minimalinvasive Verfahren wie die Endoskopie gut zugänglich ist, könnte durch diese Methode eine Reprogrammierung der eigenen Zellen eines Patienten in situ denkbar sein. Ein solcher in‑body‑Ansatz hätte mehrere potenzielle Vorteile gegenüber konventionellen Zelltherapien: er würde die Abhängigkeit von Spendergewebe reduzieren, die Herstellung vereinfachen und das Risiko der immunologischen Abstoßung mindern, sofern patienteneigene Zellen verwendet werden. Zusätzlich eröffnet die Anwendung von Organoiden als Zwischenschritt Möglichkeiten zur Qualitätskontrolle vor der Implantation.
Gleichzeitig sind erhebliche wissenschaftliche und klinische Hürden zu überwinden. Die Autoren berichten die Ergebnisse in Stem Cell Reports (6. November), betonen jedoch, dass Sicherheit, Robustheit und Langzeitfunktion gründlich geprüft werden müssen, bevor klinische Studien am Menschen denkbar sind. Offene Fragen betreffen die präzise Steuerung der Reprogrammierung, die Verhinderung unerwünschter Differenzierung oder Proliferation, das Management potenzieller Tumorbildung und die Gewährleistung, dass das Immunsystem die neu entstandenen insulinproduzierenden Zellen nicht attackiert — insbesondere bei Typ‑1‑Diabetes, einer Autoimmunerkrankung.
What comes next: paths and challenges
Die nächsten Forschungsschritte werden sich darauf konzentrieren, den genetischen Schalter zu verfeinern, die Langzeitüberlebensfähigkeit und funktionelle Stabilität der umprogrammierten Zellen zu testen sowie Strategien zu entwickeln, die konvertierten Zellen Schutz vor autoimmunologischer Zerstörung bieten. Solche Strategien könnten Immunmodulation, gezielte lokale Immunsuppression, physische Einkapselung (encapsulation) oder die Kombination mit Toleranzinduktion umfassen. Vergleichende Studien werden außerdem notwendig sein, um die Effizienz dieser Magen‑Reprogrammierung gegenüber etablierten regenerativen Ansätzen wie Stammzell‑abgeleiteten Inselzellen, mikroverkapselten Inseln oder genetisch modifizierten allogenen Transplantaten zu bewerten.
Wenn sich die Methode als sicher und effektiv erweist, könnte die Reprogrammierung von Magengewebe Teil eines wachsenden Instrumentariums für die Wiederherstellung physiologischer Insulinproduktion werden. Sie würde die Optionspalette ergänzen: von patientenspezifischen, autologen Therapien über biotechnologische Herstellungsprozesse bis zu kombinatorischen Lösungen, die Immunschutz und Zellfunktion vereinen. Technisch betrachtet bietet die Nutzung von Magen‑Organoiden Vorteile bei Skalierbarkeit und Standardisierung, da Organoid‑Kulturen in kontrollierbaren Bioreaktoren expandiert und vor der Rücktransplantation analysiert werden können — wichtige Aspekte für die spätere klinische Translation und die Einhaltung regulatorischer Anforderungen.
Für die Grundlagenforschung sind die Ergebnisse ebenfalls relevant: Sie zeigen, dass endodermale Organe wie Magen und Pankreas eine größere Plastizität besitzen als zuvor angenommen, was neue Einsichten in die Entwicklungsbiologie, Zellidentität und Epigenetik erlaubt. Die Identifikation der Schlüsselfaktoren, die eine Betazell‑ähnliche Differenzierung in Magenepithelzellen ermöglichen, liefert auch Hinweise für die gezielte Manipulation anderer Zelltypen zur Regeneration hormonproduzierender Zellen.
In der klinischen Perspektive müssen zudem logistische und ethische Aspekte berücksichtigt werden. Klinische Prüfungen würden strenge Endpunkte erfordern — etwa dauerhafte Glykämiekontrolle, Reduktion exogener Insulinbedarfe, Sicherheit hinsichtlich Onkogenität und organübergreifende Effekte, sowie Lebensqualität der Patienten. Ein weiterer Fokus liegt auf der Kommerzialisierung: Herstellungsprozesse für genetisch programmierte Organoide müssten skalierbar und reproduzierbar sein, Qualitätskriterien und Freigabeparameter etabliert werden, und die Kosten‑Nutzen‑Bilanz gegenüber bestehenden Therapien wäre zu evaluieren.
Diese Studie liefert zunächst ein faszinierendes Konzept: der Magen, klassischerweise nicht mit der Blutzuckerregulation assoziiert, kann potenziell als Quelle für Insulin dienen. Dieser Perspektivwechsel eröffnet neue Wege für zellbasierte Diabetestherapien und zeigt, wie interdisziplinäre Forschung kreative Lösungen für chronische Erkrankungen entwickeln kann. Für die Translation in die klinische Praxis sind jedoch umfassende präklinische Daten, Sicherheitsnachweise und Modelle für den Immunschutz nötig, bevor Patienten von solchen Innovationen profitieren könnten.
Technisch gesehen umfasst die Reprogrammierung mehrere Ebenen: Auswahl von Transkriptionsfaktoren und Epigenetik‑Modulatoren, Design von induzierbaren Expressionssystemen (z. B. doxycyclinabhängige oder ligandengesteuerte Schaltkreise), Optimierung der Vektoren für humane Anwendungen (viral versus nicht‑viral), und die Implementierung von Kontrollmechanismen zur Abschaltung oder Eliminierung der modifizierten Zellen bei Nebenwirkungen. Ferner wird die Interaktion zwischen umprogrammierten Zellen und dem umgebenden stroma‑ und immunologischen Mikromilieu entscheidend für die Langzeitfunktion sein — Aspekte, die zukünftige Studien gezielt adressieren müssen.
Abschließend lässt sich sagen, dass die Reprogrammierung von Magengewebe zu insulinproduzierenden Zellen eine spannende Ergänzung zu bestehenden Forschungsansätzen darstellt. Sie verbindet die Vorteile patienteneigener Zellen und minimalinvasiver Zugänglichkeit mit modernen Methoden der Genprogrammierung und Organoid‑Technologie. Durch weitere Forschung, strenge Sicherheitsprüfungen und interdisziplinäre Kooperationen könnte dieses Konzept langfristig zur Entwicklung innovativer, personalisierter Therapien für Typ‑1‑Diabetes beitragen.
Quelle: scitechdaily

Kommentar hinterlassen