7 Minuten
Stem cell transplantation reverses stroke damage in mice
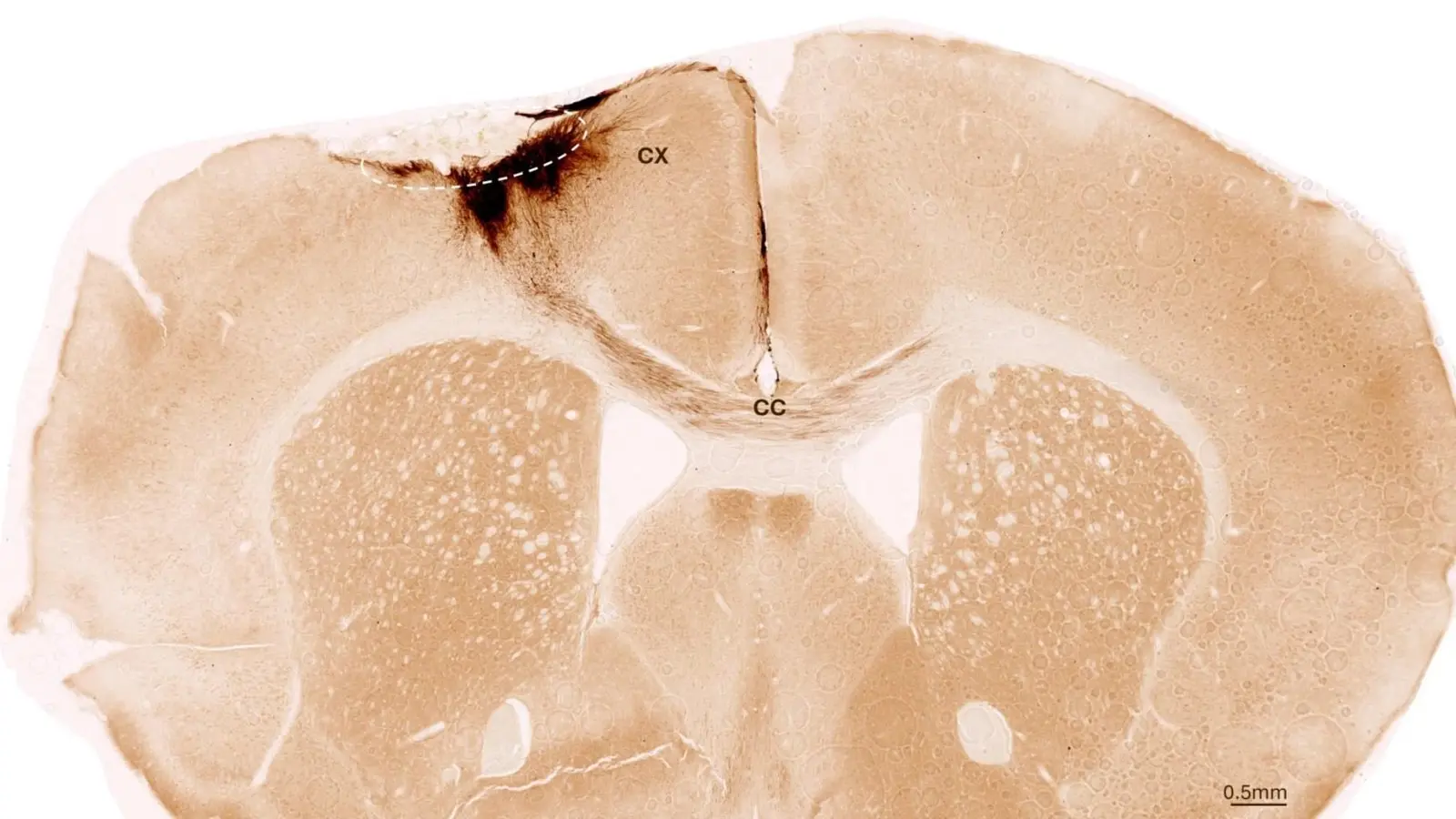
Dieses Bild zeigt einen koronalen Schnitt durch das Mausgehirn nach Schlaganfall und Transplantation neuronaler Stammzellen. Der gestrichelte Kreis markiert das Schlaganfallareal. Die Neuritenprojektionen der transplantierten menschlichen Zellen sind dunkelbraun angefärbt. Neurite erstrecken sich lokal in die Cortexregion (CX), aber auch über das Corpus callosum (CC) in die andere Hemisphäre. Quelle: University of Zurich
Forscherinnen und Forscher der Universität Zürich (UZH) haben in Zusammenarbeit mit Teams aus den Vereinigten Staaten und Japan gezeigt, dass menschliche neuronale Stammzellen beschädigtes Hirngewebe nach einem Schlaganfall bei Mäusen regenerieren können. Die transplantierten Zellen überlebten mehrere Wochen, differenzierten zu Neuronen, integrierten sich in die Wirtsnetzwerke und lösten darüber hinaus umfassendere Reparaturprozesse aus, die die motorische Funktion verbesserten. Diese Ergebnisse stellen einen wichtigen Schritt in Richtung klinischer Strategien zur Hirnregeneration und Nachsorge nach Schlaganfall dar.
Scientific context and experimental design
Der Schlaganfall ist weltweit eine der Hauptursachen für dauerhafte Behinderungen im Erwachsenenalter; Schätzungen zufolge erleidet etwa einer von vier Erwachsenen im Laufe seines Lebens einen Schlaganfall. Ischämische Schlaganfälle sowie intrazerebrale Blutungen führen zum Verlust von Neuronen und anderen Hirnzellen, häufig irreversibel, was langfristige Einschränkungen bei Bewegung, Sprache und kognitiven Fähigkeiten nach sich zieht. Die konventionelle Versorgung konzentriert sich heute auf die Begrenzung des akuten Schadens und auf Rehabilitation. Eine etablierte Therapie, die verlorene Neuronen ersetzt oder beschädigtes Hirngewebe vollständig wiederaufbaut, existiert bislang nicht.
Um zu untersuchen, ob neuronale Stammzellen beschädigtes Hirngewebe rekonstruieren können, nutzten die Forschungsteams menschliche neuronale Stammzellen, die aus induzierten pluripotenten Stammzellen (iPSCs) gewonnen wurden. iPSCs stammen aus normalen somatischen (erwachsenen) menschlichen Zellen, die in einen pluripotenten Zustand zurückprogrammiert und anschließend in neuronale Stammzellen differenziert wurden. Solche Zellen sind in der Lage, mehrere neuronale Zelltypen zu bilden und bieten damit eine vielseitige Ausgangsbasis für Reparaturstrategien.
Die Forschenden induzierten bei Mäusen einen permanenten fokalen Schlaganfall, der wesentliche pathologische und verhaltensrelevante Merkmale des menschlichen Schlaganfalls nachbildet. Die Tiere wurden immunologisch modifiziert, um eine Abstoßung menschlicher Zellen zu vermeiden; dies ermöglichte eine Langzeitbeobachtung des Zellschicksals. Eine Woche nach dem Schlaganfall transplantierte das Team neuronale Stammzellen in das Läsionsgebiet — ein bewusst gewählter Zeitpunkt, der eine klinisch realistische Fensterperiode abbildet und der lokalen Umgebung Zeit gibt, sich zu stabilisieren.
Für die Bewertung des Outcomes setzte die Arbeitsgruppe multimodale Methoden ein: Histologie und Immunfärbung zur Verfolgung von Zellüberleben und Differenzierung, molekulare Assays zur Einschätzung von Entzündungsprozessen und Gefäßintegrität sowie hochauflösende Bildgebung zur Analyse struktureller Integration. Die Verhaltensmessung zur Bestimmung der funktionellen Erholung erfolgte mittels automatisierter, KI-gestützter Gangbildanalyse, die subtile Verbesserungen in Koordination und Schaftnutzung objektiv erfassen kann.
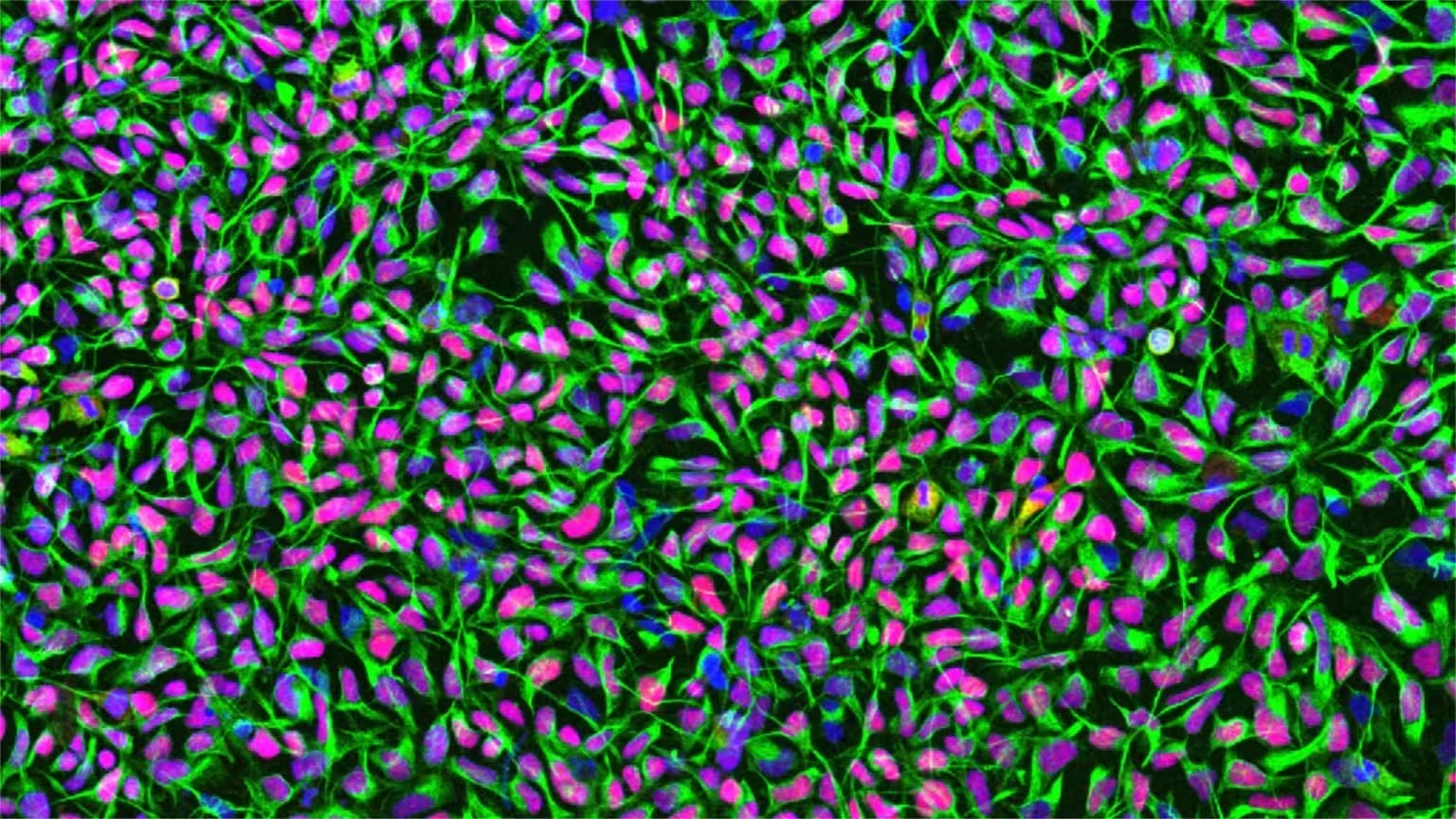
Menschliche neuronale Stammzellen in Kultur. Zellkerne sind blau gefärbt, das für neuronale Stammzellen charakteristische Filamentprotein Nestin ist grün dargestellt und der Transkriptionsfaktor Sox1 in Rot. Quelle: University of Zurich
Major findings: neurogenesis plus systemic repair
Die transplantierten menschlichen neuronalen Stammzellen überlebten über den gesamten fünf Wochen langen Beobachtungszeitraum und differenzierten überwiegend zu Neuronen. Besonders bedeutsam war, dass viele dieser neu gebildeten Neuronen Neurite ausbildeten und mutmaßliche synaptische Kontakte mit der Wirtszellpopulation eingingen, was auf funktionelle Integration und nicht nur auf ein temporäres Vorhandensein hindeutet. Solche strukturellen Verbindungen sind Voraussetzung dafür, dass transplantierte Zellen tatsächlich neuronale Schaltkreise reetablieren und Signalverarbeitung wieder ermöglichen.
Neben der direkten Neurogenese beobachteten die Forschenden mehrere ergänzende regenerative Effekte, die gemeinsam ein günstigeres Milieu für Reparaturprozesse schufen:
- Angiogenese und Gefäßreparatur: In und um die Läsion bildeten sich vermehrt neue Blutgefäße, was die metabolische Versorgung des betroffenen Gewebes verbesserte und damit die Voraussetzung für dauerhafte Regeneration schuf.
- Verminderte Entzündungsreaktion: Lokale inflammatorische Antworten — die oft sekundäre Schäden verstärken — wurden nach der Transplantation abgeschwächt, was Zellüberleben und Heilungsprozesse förderte.
- Verbesserte Blut-Hirn-Schranken-(BHS-)Integrität: Messungen zur Funktion der Blut-Hirn-Schranke zeigten eine bessere Abgrenzung der mikroökologischen Bedingungen im Gehirn, wodurch schädliche Infiltrationen reduziert wurden und ein stabileres Umfeld für die neu entstandenen Zellen entstand.
Durch das Zusammenspiel dieser Prozesse entstand eine deutlich permissivere Umgebung für Geweberegeneration und funktionelle Wiederherstellung. Verhaltensassays bestätigten eine teilweise Umkehr der durch den Schlaganfall verursachten motorischen Defizite: Mäuse, die Stammzellen erhielten, zeigten messbare Verbesserungen im Gangbild und in der Koordination der Gliedmaßen verglichen mit Kontrolltieren. Diese Unterschiede wurden durch die KI-gestützte Analyse objektiv verifiziert und statistisch abgesichert.
Translation considerations and safety strategies
Im Hinblick auf die Translation in die klinische Anwendung stellten die Forschenden die Stammzellen mit xeno-freien Protokollen her (d. h. ohne tierische Reagenzien), eine Vorgehensweise, die in Zusammenarbeit mit dem Center for iPS Cell Research and Application (CiRA) der Kyoto University entwickelt wurde. Xeno-freie Herstellungsprozesse sind eine wichtige regulatorische und sicherheitsrelevante Voraussetzung für die Anwendung am Menschen, da sie das Risiko von Kontaminationen durch tierische Komponenten reduzieren und die Standardisierung für klinische Prüfungen erleichtern.
Die zeitliche Planung erwies sich als klinisch relevante Variable: Die Studie zeigte günstigere Ergebnisse, wenn die Transplantation eine Woche nach dem Schlaganfall erfolgte, statt unmittelbar danach. Dieses verzögerte Fenster kann logistische Vorteile bieten, etwa bei der Herstellung der Zellen, beim Screening geeigneter Patientinnen und Patienten sowie bei der Planung sicherheitsrelevanter Maßnahmen vor der Gabe.
Sicherheit bleibt ein zentrales Anliegen. Die Wissenschaftlerinnen und Wissenschaftler entwickeln daher genetisch steuerbare "Safety-Switch"-Systeme, um unkontrollierte Zellproliferation zu verhindern oder bei Bedarf transplantierte Zellen selektiv zu eliminieren. Zudem werden weniger invasive Applikationswege geprüft, beispielsweise endovaskuläre Injektionen, die in vielen klinischen Szenarien praktikabler wären als direkte parenchymale Transplantationen. Parallel dazu laufen bereits klinische Programme in Japan, in denen iPSC-abgeleitete Zellen bei der Parkinson-Erkrankung eingesetzt werden; diese Programme zeigen mögliche regulatorische Wege und erste Erfahrungen in der Translation von iPSC-Technologien in den Menschen. Vor diesem Hintergrund ist Schlaganfall eine denkbare nächste Indikation für sorgfältig designte klinische Studien.
Expert Insight
"Diese Ergebnisse liefern überzeugende Belege dafür, dass neuronale Stammzellen mehr leisten können als nur verlorene Neurone zu ersetzen — sie verändern das lokale Umfeld und fördern zugleich gefäßbezogene und immunologische Erholungsprozesse", erklärt Dr. Laura Hernandez, eine fiktive Expertin für Neurorehabilitation und translationale Neurowissenschaften. "Die Überführung dieses Ansatzes in die Patientenversorgung wird strenge Sicherheitskonzepte, eine skalierbare Herstellung nach klinischen Standards und klar definierte Liefermethoden erfordern. Dennoch ist die Aussicht, nach einem Schlaganfall Funktion wiederherzustellen, heute greifbarer als noch vor fünf Jahren."
Conclusion
Die von der UZH geleiteten Studien zeigen, dass menschliche neuronale Stammzellen, die aus iPSCs gewonnen wurden, überleben, differenzieren und einen substanziellen Beitrag zur strukturellen und funktionellen Erholung nach experimentellen Schlaganfällen bei Mäusen leisten können. Indem sie Neurogenese mit Gefäßreparatur und Immunmodulation kombinieren, führten die Stammzelltransplantationen zu messbaren motorischen Verbesserungen. Laufende Arbeiten an Sicherheitsmechanismen, xeno-freier Produktion und minimalinvasiven Applikationswegen werden entscheidend sein, um zu bestimmen, wie schnell und in welchem Umfang diese Befunde in klinische Studien überführt werden können. Gelingt die Translation, könnte eine Therapie mit neuronalen Stammzellen eine transformative Option zur Wiederherstellung von Hirnleistung nach Schlaganfall darstellen.
Quelle: scitechdaily

Kommentar hinterlassen