5 Minuten
Forscher der Johns Hopkins Medicine haben mikroskopische Nanoröhren-Kanäle zwischen Neuronen identifiziert, die toxische Moleküle transportieren können — eine Entdeckung, die eine zuvor unerkannte Verbindungsebene der Gehirnkonnektivität offenbart und helfen könnte zu erklären, wie sich Alzheimer-Pathologie ausbreitet. Mithilfe hochauflösender Bildgebung an Mäusen und anhand menschlicher Elektronenmikroskopie-Datensätze beobachtete das Team lange, schlanke dendritische Nanoröhren, die Amyloid-beta und andere kleine Toxine zwischen Zellen transportieren und damit ein neues Ziel für künftige Therapien nahelegen.
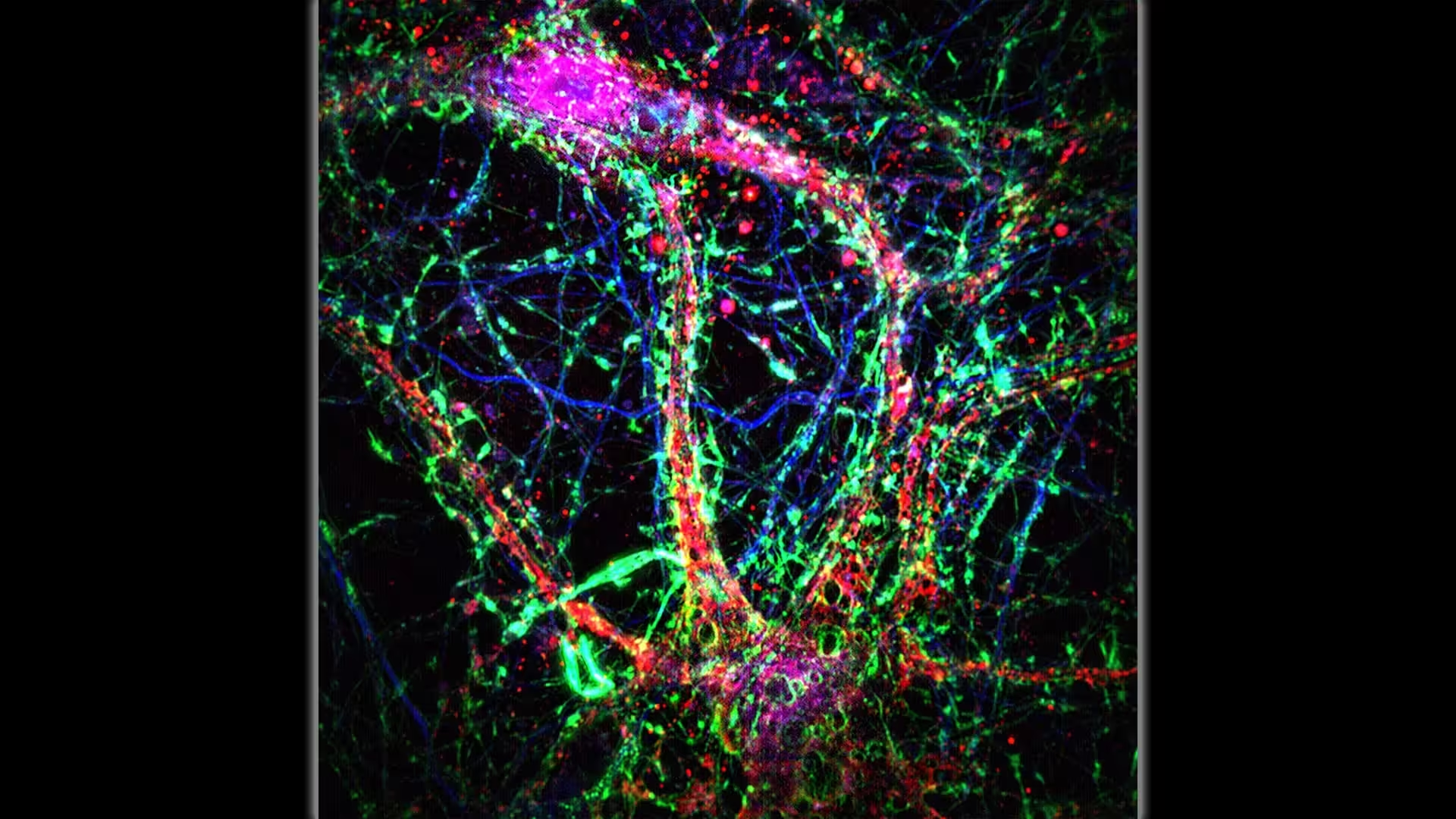
Wissenschaftler der Johns Hopkins Medicine erklären, dass interzelluläre Nanoröhren (dünne, überwiegend grün gefärbte, brückenähnliche Verbindungen) eine zusätzliche Schicht der Kommunikation innerhalb neuronaler Netzwerke beitragen. Credit: Minhyeok Chang, Ph.D.
Was das Team fand und warum es wichtig ist
Stellen Sie sich vor, Neuronen kommunizieren nicht nur über Synapsen, sondern senden auch winzige Pakete durch röhrenartige Brücken. Dieses Bild entsteht aus einer Studie, die am 2. Oktober in Science veröffentlicht wurde und in der die Forschenden eine „nanoröhrenartige Konnektivitätsschicht" im Säugetiergehirn beschrieben. Diese Nanoröhren — extrem dünne membranöse Kanäle, die Dendriten benachbarter Neuronen verbinden — scheinen Ionen, Calcium und kleine toxische Moleküle wie Amyloid‑beta von Zelle zu Zelle zu transportieren.
„Zellen müssen toxische Moleküle loswerden, und indem sie eine Nanoröhre bilden, können sie dieses toxische Molekül an eine Nachbarzelle übertragen“, sagte Hyungbae Kwon, außerordentlicher Professor für Neurowissenschaften an der Johns Hopkins University School of Medicine und korrespondierender Autor der Studie. „Leider führt dies auch dazu, dass schädliche Proteine in andere Bereiche des Gehirns verbreitet werden.“
Die Doppelnatur der Nanoröhren — ein Mechanismus zur Abfallbeseitigung, der gleichzeitig toxische Fracht verbreiten kann — bietet Neurowissenschaftlern einen neuen Rahmen, um frühstadiale Neurodegeneration zu verstehen. Computermodelle, die das Team ausführte, zeigten Muster früher Amyloid‑Akkumulation, wie sie in Alzheimer-Modellmäusen beobachtet wurden, und stützen die Idee, dass ein nanotubenvermittelter Transfer die lokale Aussaat pathologischer Proteine beschleunigen könnte.
Wie die Entdeckung gemacht wurde: Methoden und Belege
Die Forschenden kombinierten genetische Mausmodelle, die zu Amyloidansammlungen neigen, mit Live‑Zell‑Hochauflösungsmikroskopie, um die Bildung von Nanoröhren in Gehirnschnitten sichtbar zu machen. Sie dokumentierten lange, säulenartige Ausstülpungen, die Dendriten überspannten, und verfolgten direkt die Bewegung fluoreszenzmarkierter Moleküle durch diese Kanäle. Um die Relevanz für den Menschen zu überprüfen, untersuchten sie öffentlich verfügbare menschliche Elektronenmikroskopie‑Datensätze und fanden Nanoröhren mit vergleichbarer Morphologie, die menschliche Neuronen verbanden.
Bei Mäusen, die so genetisch programmiert waren, Alzheimer‑ähnliche Amyloidplaques zu entwickeln, war die Anzahl der Nanoröhren im Alter von drei Monaten erhöht — einer Phase, in der die Tiere noch keine äußeren Symptome zeigen. Nach sechs Monaten, wenn die Plaque‑Pathologie ausgeprägter wird, näherten sich die Nanoröhrenzahlen zwischen transgenen und Kontrollmäusen an. Diese zeitlichen Dynamiken deuten darauf hin, dass die Proliferation von Nanoröhren besonders in frühen, präsymptomatischen Krankheitsphasen aktiv sein könnte.
Unterstützendes Team und Finanzierung
Das Projekt wurde von Kwon geleitet mit Beiträgen von Minhyeok Chang, Sarah Krüssel, Juhyun Kim, Daniel Lee, Alec Merodio und Jaeyoung Kwon an der Johns Hopkins University sowie den Kooperationspartnern Laxmi Kumar Parajuli und Shigeo Okabe an der Universität Tokio. Gefördert wurde die Arbeit durch die National Institutes of Health (DP1MH119428 und R01NS138176).
Folgen für die Alzheimer‑Forschung und mögliche Therapien
Diese Ergebnisse eröffnen mehrere translationale Wege. Wenn dendritische Nanoröhren ein Pfad für die Verbreitung von Amyloid‑beta sind, dann könnte die Modulation ihrer Bildung — entweder durch Unterdrückung, um die Ausbreitung zu begrenzen, oder durch vorübergehende Verstärkung, um die Clearance toxischer Moleküle zu verbessern — eine therapeutische Strategie darstellen. Kwon und Kolleginnen und Kollegen schlagen weitere Experimente vor, in denen Nanoröhren gezielt erzeugt oder blockiert werden, um zu testen, wie solche Eingriffe die neuronale Gesundheit, Proteinaggregation und kognitive Ergebnisse in Tiermodellen beeinflussen.
Über Alzheimer hinaus könnten Nanoröhrennetze auch bei anderen neurodegenerativen Erkrankungen eine Rolle spielen, in denen fehlgefaltete Proteine von Zelle zu Zelle verbreitet werden, wie Parkinson oder ALS. Die strukturellen und funktionellen Eigenschaften dieser Nanoröhren — ihre Länge, ihr Durchmesser und ihre Selektivität für bestimmte molekulare Fracht — werden entscheidende Details für Arzneimittelentwickler und Neurowissenschaftler sein, die Interventionen anstreben.
Experteneinblick
„Diese Entdeckung fügt unserer Karte neuronaler Kommunikation eine neue Schicht hinzu“, sagte Dr. Elena Vargas, eine fiktive Neurobiologin und Wissenschaftskommunikatorin mit Erfahrung in Studien zur Proteinaggregation. „Sie verändert unsere Sicht auf zelluläre Abfallentsorgung und die unbeabsichtigten Folgen dieser Mechanismen. Die Zielrichtung der Nanoröhren‑Dynamik könnte ein kluger Ansatz sein, um früh in die Krankheitsprogression einzugreifen, aber wir brauchen sorgfältige Studien, um nützliche Clearance‑Wege nicht zu stören.“
Die nächsten Schritte für das Team der Johns Hopkins umfassen das Kartieren von Nanoröhrennetzen über verschiedene Gehirnzelltypen hinweg, das gezielte Erzeugen von Nanoröhren in vitro und das Testen, ob die Veränderung der Häufigkeit von Nanoröhren den Verlauf der Amyloidose in vivo beeinflusst. Gelingt dies, könnten diese Forschungsansätze auf Arzneimittelziele oder gentechnisch hergestellte Biologika hinweisen, die interzelluläre Nanoröhren selektiv modulieren.
Vorläufig stellt die Entdeckung die frühe Alzheimer‑Pathologie in ein anderes Licht: nicht nur als lokale Plaquebildung, sondern als einen dynamischen Prozess, der von mikroskopischen Kanälen beeinflusst wird, die neuronale Gemeinschaften verbinden. Diese neue Perspektive könnte die Suche nach Biomarkern und die Entwicklung früher Interventionen, die das Fortschreiten der Erkrankung verlangsamen oder stoppen, verändern.
Quelle: sciencedaily

Kommentar hinterlassen