8 Minuten
Neue Forschungsdaten deuten darauf hin, dass die Alzheimer-Krankheit die 24-Stunden-genetischen "Uhren" in den nicht-neuronalen Stützzellen des Gehirns stören kann und dadurch verändert, wann wichtige Risikogene an- und abgeschaltet werden. Diese Störung könnte beeinflussen, wie das Gehirn toxische Proteine abbaut und die tägliche neuronale Funktion aufrechterhält – und öffnet damit einen vielversprechenden neuen Pfad für potenzielle Therapien gegen Alzheimer, einschließlich chronotherapeutischer Ansätze und gezielter Modulation zirkadianer Mechanismen.
Was die Forschenden untersuchten und warum es wichtig ist
Wissenschaftlerinnen und Wissenschaftler der Washington University School of Medicine verglichen die Genaktivität über den Tagesverlauf in Hirnen gesunder Mäuse mit der Genaktivität in Mäusen, die genetisch so verändert wurden, dass sie amyloidähnliche Plaques entwickeln – einer Kerncharakteristik der Alzheimer-Pathologie. Im Zentrum der Untersuchung standen zwei nicht-neuronale Zelltypen: Astrozyten, die Neuronen metabolische und strukturelle Unterstützung liefern, und Mikroglia, die residenten Immunzellen des Gehirns, die Abfallstoffe und beschädigte Strukturen beseitigen. Die Forschungsteams validierten ihre Ergebnisse anschließend anhand menschlichen Hirngewebes, um Relevanz für den Menschen zu prüfen und übertragbare Erkenntnisse zu gewinnen.
Das zentrale Konzept der Studie ist der zirkadiane Rhythmus, das interne Zeitsystem, das Schlaf, Stoffwechselvorgänge und zahlreiche zelluläre Aufgaben über einen etwa 24-Stunden-Zyklus koordiniert. Obwohl zirkadiane Dysregulation seit langem mit Demenz und Schlafstörungen bei Patientinnen und Patienten in Verbindung gebracht wird, geht diese Arbeit einen Schritt weiter: Sie analysiert, wie sich die täglichen Oszillationen der Genexpression in spezifischen Hirnzellen während der Erkrankung verschieben. Diese Feinauflösung liefert mechanistische Einblicke, die über einfache Beobachtungen von Schlafstörungen hinausgehen und mögliche molekulare Targets für Interventionen aufzeigen.
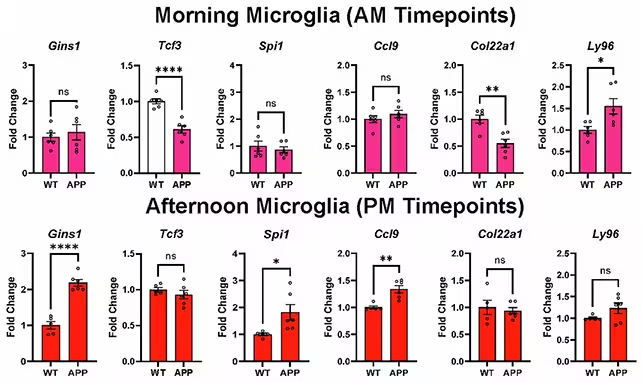
Wichtige Entdeckungen: Welche Gene im Takt gefangen sind
Von 82 Genen, die zuvor mit einem erhöhten Alzheimer-Risiko in Verbindung gebracht wurden, zeigten die Forschenden, dass etwa die Hälfte eine zirkadiane Regulation in Gliazellen aufweist. Das bedeutet: Die Aktivität vieler Alzheimer-assoziierter Gene steigt und fällt bei gesunden Gehirnen im Tagesrhythmus – und diese Rhythmen sind im Krankheitsmodell verändert. Solche Befunde legen nahe, dass das Risiko durch zeitlich gesteuerte Genaktivitäten moduliert wird und dass Störungen dieser Rhythmen pathogenetische Prozesse begünstigen könnten.
Beim Verfolgen der Genexpression in Mikroglia über den Tagesverlauf zeigten sich ausgeprägte Verschiebungen, sobald Alzheimer-Pathologie vorhanden war. Diese uhrgetriebenen Veränderungen könnten die Fähigkeiten der Gliazellen beeinflussen, zentrale Aufgaben wie die Clearance von Amyloid-beta, die Regulation von Entzündungsreaktionen und die Aufrechterhaltung eines homöostatischen Milieus zu erfüllen. Da Mikroglia und Astrozyten wichtige Rollen bei Immunüberwachung, Synapsen-Remodelling und metabolischer Unterstützung spielen, hat eine Verschiebung ihrer zeitlichen Aktivierung direkte Auswirkungen auf die Gesamthirnfunktion und die Anfälligkeit gegenüber Proteinaggregation und Neurodegeneration.
In welche Richtung läuft die Kausalität?
Eine zentrale, bislang nicht abschließend geklärte Frage bleibt: Verursacht die Ansammlung von Amyloid-Plaques die Dysregulation der zellulären Uhren, oder erhöht eine abgeschwächte zirkadiane Uhr das Risiko für Plaquebildung? Die Forschenden tendieren zu der Auffassung, dass veränderte zirkadiane Zeitgeber in bestimmten Zelltypen zur Krankheitsprogression beitragen, doch die Beziehung ist wahrscheinlich bidirektional: Pathologische Prozesse können Uhrfunktionen beeinträchtigen, während gestörte Uhren die Anfälligkeit für weitere pathologische Veränderungen erhöhen und beide Mechanismen sich wechselseitig verstärken. Diese Dynamik weist auf komplexe Interaktionen zwischen Genregulation, Immunantwort, Proteinhomöostase und zellulärer Chronobiologie hin.
Warum Timing für Reinigung und Symptome des Gehirns wichtig ist
Ungefähr 20 % der menschlichen Gene schwanken in Abhängigkeit vom zirkadianen Zyklus und steuern Prozesse von der Verdauung bis zur Gewebereparatur. Wenn die Uhren der Gliazellen aus dem Takt geraten, kann sich auch das Timing von Abfallbeseitigung, Immunüberwachung und metabolischer Unterstützung verschieben – mit Folgen wie einer verminderten Beseitigung toxischer Proteine, anhaltenden Entzündungsreaktionen und erhöhter Vulnerabilität gegenüber neurodegenerativen Prozessen.
Auf klinischer Ebene äußert sich eine zirkadiane Störung in gut erkennbaren Symptomen. Menschen mit Alzheimer zeigen häufig fragmentierten Schlaf, veränderte Schlaf-Wach-Rhythmen und eine Verschlechterung der Verwirrtheit am späten Nachmittag und Abend, ein Phänomen, das als "Sundowning" bezeichnet wird. Die neuen molekularen Daten verknüpfen diese klinischen Befunde mit greifbaren Verschiebungen in der Genregulation innerhalb der zellulären Reinigungs- und Immunzellen des Gehirns. Solche Zusammenhänge liefern plausiblen biologischen Unterbau für Symptome, die zuvor vorwiegend klinisch beschrieben wurden, und geben Hinweise darauf, welche Zeitpunkte für therapeutische Interventionen am sinnvollsten sein könnten.
Therapeutische Möglichkeiten: Die Uhren des Gehirns neu einstellen
Da viele mit Alzheimer assoziierte Gene zirkadian gesteuert sind, schlagen die Autorinnen und Autoren der Studie einen neuartigen therapeutischen Ansatz vor: die gezielte Modulation der zellulären Uhr. Dies kann bedeuten, Rhythmen in vorteilhaften Zelltypen zu stärken, schädliche Oszillationen zu dämpfen oder die Timing-Parameter in Mikroglia und Astrozyten selektiv so zu verändern, dass die effiziente Clearance von Amyloid gefördert und entzündliche Fehlreaktionen reduziert werden. Solche Ansätze würden die klassische Strategy, lediglich Aggregation zu verhindern, um eine zeitliche Dimension erweitern.
Praktische Umsetzungswege könnten pharmakologische Substanzen sein, die Kernbestandteile der zirkadianen Uhr (z. B. CLOCK, BMAL1, PER-, CRY-Proteine) gezielt modulieren; zeitlich gesteuerte Verabreichung bestehender Wirkstoffe (Chronotherapie), bei der Medikamente zu festen Tageszeiten appliziert werden, um maximale Wirksamkeit und minimale Nebenwirkungen zu erzielen; sowie Lebensstilinterventionen wie kontrollierte Lichttherapie, Schlaf-Wach-Planung, Mahlzeiten-Timing und körperliche Aktivität, die systemisch gesunde Rhythmen fördern. Solche Methoden haben den Vorteil, dass sie sowohl direkt auf zelluläre Uhren wirken als auch systemische Effekte entfalten, die den Gesamtmetabolismus und die Immunfunktion beeinflussen.
Was als Nächstes für Forschung und Behandlung kommt
Die Studie eröffnet mehrere experimentelle Richtungen: Erstens die klärende Bestimmung kausaler Zusammenhänge zwischen Uhren-Störungen und Plaque-Akkumulation, etwa durch Einsatz von Gen-Knockouts oder zeitgesteuerten Aktivierungsprotokollen in Tiermodellen. Zweitens die Prüfung, ob das Zurücksetzen zirkadianer Rhythmen in Gliazellen bestehende Pathologie tatsächlich rückgängig macht oder deren Progression verlangsamt – hier sind präklinische Interventionsstudien in Mäusen sowie komplexe In-vitro-Modelle, etwa 3D-Organoide und humanisierte Zellkulturen, wichtige nächste Schritte.
Drittens die Translation sicherer, zeitbasierter Interventionen in frühe klinische Studien: Design von Studien, die Chronotherapie, Lichtinterventionen oder gezielte medikamentöse Modulation der Kernuhrproteine testen, idealerweise in frühen Krankheitsstadien oder bei Menschen mit erhöhtem genetischem Risiko (z. B. APOE4-Träger). Eine optimierte zirkadiane Biologie könnte traditionelle Strategien ergänzen, die auf Reduktion von Proteinaggregation oder Modulation der Immunantwort zielen, und so ein multimodales Interventionspaket für Prävention und frühe Behandlung bilden.
Fachliche Einordnung
"Diese Arbeit stellt einen Teil von Alzheimer sowohl als eine Störung der zeitlichen Steuerung wie auch als eine Störung molekularer Schäden dar", sagt Dr. Lydia Farrow, eine fiktive Neuroimmunologin mit Schwerpunkt zirkadiane Neurowissenschaft. "Wenn es gelingt, das Timing der Genaktivität in Mikroglia und Astrozyten fein zu justieren, könnten wir die häuslichen Reinigungsfunktionen des Gehirns so lange erhalten, dass nachgelagerte Degeneration verlangsamt oder verhindert wird." Solche Aussagen verdeutlichen die translationalen Ambitionen moderner Forschung: Mechanismen zu verstehen, die sich sowohl auf molekularer als auch auf systemischer Ebene therapeutisch ansprechen lassen.
Die Studie, veröffentlicht in Nature Neuroscience, baut auf einer wachsenden Evidenzbasis auf, die zeigt, dass unsere inneren Uhren eng mit der Gehirngesundheit verwoben sind. Durch das Kartieren, welche Alzheimer-Risikogene im Tagesverlauf ansteigen und fallen, haben die Forschenden eine neue biologische Ebene aufgedeckt, die für frühe Interventionen und biomarkerbasierte Diagnoseansätze entscheidend sein könnte. Langfristig könnten Zeitgeber-bewusste Biomarker helfen, individuelle Therapiezeitpunkte zu optimieren und so Wirksamkeit und Verträglichkeit von Behandlungen zu verbessern.
Technisch gesehen lässt sich die zirkadiane Modulation nicht losgelöst von weiteren Stellschrauben betrachten. Dazu zählen genetische Risikofaktoren wie APOE, TREM2, APP, PSEN1/2, aber auch Umweltfaktoren – chronische Stressbelastung, Lichtexposition, Ernährung und körperliche Aktivität – die zusammen das zelluläre Zeitgebernetz beeinflussen. Eine integrierte Forschungsperspektive, die Genetik, Zellbiologie, Verhaltensmedizin und Chronobiologie verbindet, ist daher unerlässlich, um wirksame, individualisierte Therapiestrategien zu entwickeln.
Zu den methodischen Herausforderungen zählen die heterogene Natur von Alzheimer-Patientengruppen, Unterschiede in Lebensstil und Komorbiditäten sowie das Problem der zeitlichen Probenentnahme beim Menschen: Menschliches Hirngewebe ist oft nur postmortem verfügbar, sodass longitudinale, nicht-invasive Biomarker (z. B. zirkadiane Schwankungen in Blut- oder Liquorparametern, digitale Schlaf- und Aktivitätsdaten) an Bedeutung gewinnen werden. Gleichzeitig bieten Fortschritte in Single-Cell-Transkriptomik und Zeitreihenanalyse neue Werkzeuge, um zelltypspezifische Rhythmik detailliert zu untersuchen.
Abschließend lässt sich sagen, dass die Verbindung von Alzheimer-Forschung und Chronobiologie ein vielversprechendes, wenn auch komplexes Feld darstellt. Durch die Kombination molekularer Ansätze (Uhrgene, Uhrenproteine), präklinischer Modelle (zeitgenetische Manipulationen), klinischer Studien (Chronotherapie, Licht- und Schlafinterventionen) und innovativer Biomarkerentwicklung könnte in den kommenden Jahren ein neues Kapitel in der Prävention und Behandlung neurodegenerativer Erkrankungen aufgeschlagen werden.
Quelle: sciencealert


Kommentar hinterlassen