6 Minuten
Graue Haare können eine verborgene Botschaft Ihrer Biologie tragen: In manchen Fällen erscheint das Pigmentverloren weniger als kosmetische Besonderheit und mehr wie eine schützende Reaktion. Ein Forscherteam in Japan nutzte Mausmodelle, um zu zeigen, dass Melanozyten-Stammzellen — die Zellen, die dem Haar seine Farbe geben — auf DNA-Schäden in unterschiedlicher Weise reagieren können, sodass sie entweder vor Hautkrebs schützen oder dessen Entstehung begünstigen.
Wie DNA-Schäden, Pigment und Krebs zusammenhängen
Haut und Haare sind Grenzgewebe und sind ständig Umweltfaktoren ausgesetzt, die das Erbgut schädigen können: ultraviolette Strahlung, chemische Karzinogene und ionisierende Strahlung erzeugen DNA-Schäden. Solche Einflüsse beschleunigen nicht nur Alterungsprozesse, sondern erhöhen auch das Krebsrisiko. Wie sich diese molekularen Schäden in sichtbaren Phänomenen wie Ergrauen niederschlagen, war jedoch lange unklar und ist Gegenstand intensiver Forschung zur Hautalterung und zum Hautkrebs.
Die neue Studie konzentriert sich auf das Melanom, eine besonders gefährliche Form des Hautkrebses, die in Melanozyten entsteht — den pigmentbildenden Zellen, die aus Melanozyten-Stammzellen (McSCs) innerhalb der Haarfollikel hervorgehen. Durch Genexpressionsprofile und die Verfolgung zellulärer Schicksale in Mäusen konnten die Wissenschaftler unterschiedliche Reaktionen von McSCs auf verschiedene Arten von DNA-Schäden unterscheiden und kartieren. Diese Daten verknüpfen molekulare Stressantworten mit beobachtbaren Ergebnissen wie Pigmentverlust oder Tumorbildung.
Seno-Differenzierung: Pigment gegen Sicherheit eintauschen
Wenn Melanozyten-Stammzellen Doppelstrangbrüche in der DNA erlitten — eine besonders schwere Form von Schaden, bei der beide Stränge der DNA-Helix unterbrochen werden — neigten sie dazu, in eine irreversible Differenzierung zu gehen und anschließend zu verschwinden. Die von den Autoren beschriebene Prozedur, genannt seneszenzkopplte Differenzierung oder "seno-differentiation", beruht auf der Aktivierung des p53-p21-Signalwegs, eines zentralen Reglers für Zellzyklusstillstand und Schadensantworten. Das sichtbare Ergebnis dieses Prozesses: Das Haar verliert Pigment und wird grau.
Aus funktionaler Sicht ist dies ein eleganter biologischer Mechanismus. Indem beschädigte Stammzellen aus dem Pool der selbst erneuernden Zellen entfernt werden, reduziert das Gewebe das Risiko, dass eine dieser Zellen weitere Mutationen anhäuft und schließlich einen Tumor bildet. Anders ausgedrückt: Ein wenig Ergrauen könnte ein Zeichen dafür sein, dass der Körper organismische Sicherheit über kosmetische Erhaltung stellt. Diese Interpretation verknüpft Aspekte der Hautalterung mit evolutiven Sicherheitsstrategien auf zellulärer Ebene.
Wenn der Schutzmechanismus ausbleibt
Nicht alle Genotoxine lösen diesen schützenden Weg aus. Als die Forschenden die Haut von Mäusen Karzinogenen wie ultraviolettem B-Strahlung (UVB) und 7,12-Dimethylbenz(a)anthracen (DMBA) aussetzten — einer Chemikalie, die häufig verwendet wird, um Tumoren in experimentellen Modellen zu induzieren — verhielten sich beschädigte McSCs anders. Anstatt durch Seno-Differenzierung aus dem selbst erneuernden Pool auszutreten, behielten sie ihre Selbst-Erneuerung bei und expandierten klonal.
Die anhaltende Selbst-Erneuerung wurde durch Signale in der lokalen Stammzellnische angetrieben, insbesondere durch den Stammzellfaktor (SCF), ein Zytokin, das Melanozyten leitet und die Seno-Differenzierung unterdrückt. In der karzinogen-exponierten Umgebung erlaubten SCF und damit verbundene Signalwege, einschließlich KIT-Signalisierung und veränderter Arachidonsäure-Metabolismus, dass beschädigte McSCs persistierten und sich vermehrten — ein molekularer Pfad, der die Melanomentstehung eher fördert als Pigmentverlust.
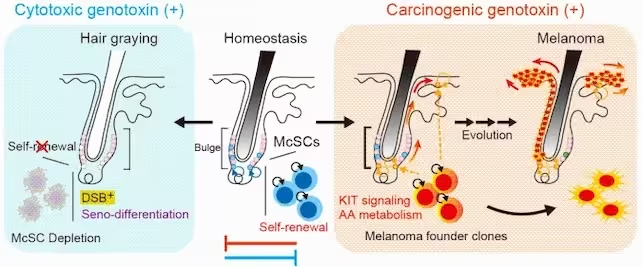
Unter Einwirkung zytotoxischer Genotoxine, wie etwa Röntgenstrahlung, ist die Selbst-Erneuerung von McSCs beeinträchtigt, was zu ihrer Erschöpfung und folglich zum Ergrauen der Haare führt. In einem homöostatischen Zustand erhalten McSCs ihre Selbst-Erneuerung und das Pigmentgleichgewicht. Karzinogene Genotoxine hingegen fördern KIT-Signale und verändern den Arachidonsäurestoffwechsel, was die Bedingungen für die Melanomentwicklung schaffen kann. (University of Tokyo)
Warum das für Hautalterung und Melanom relevant ist
Die Arbeit stellt Ergrauen und Melanom als alternative Outcomes dar, die davon abhängen, wie Stammzellen mit Stress umgehen. Entscheidet sich eine Stammzellpopulation für Erschöpfung durch Seno-Differenzierung, verliert das Gewebe Pigment, gewinnt aber möglicherweise Schutz gegen Tumorinitiierung. Versorgt die Mikro‑Umgebung die beschädigten Zellen dagegen mit Überlebenssignalen, können sich diese Zellen ausdehnen und das Krebsrisiko erhöhen. Diese Dichotomie verbindet Konzepte der Hautalterung (Hautalterung, Pigmentverlust, seneszenzbezogene Veränderungen) mit denen der Karzinogenese.
Wichtig ist die Vorsicht der Forschenden: Graue Haare sind nicht automatisch ein nachgewiesener Schutz gegen Krebs beim Menschen. Die Studie verwendet Mausmodelle, um molekulare Schaltkreise und plausible Mechanismen aufzuzeigen. Ob die gleichen Dynamiken in menschlicher Haut gelten, muss durch weiterführende Untersuchungen geprüft werden, die das Verhalten menschlicher McSCs, Umweltexpositionen und Nischen-Signalisierung in Relation zu Pigmentverlust und Melanom-Inzidenz analysieren.
Experimentelle Details und molekulare Akteure
Das Team kombinierte Genexpressions-Profiling, gezielte DNA-schädigende Behandlungen und zelluläres Lineage-Tracing in Mäusen. Sie unterscheiden zwei generelle Schadenskontexte: zytotoxische Genotoxine wie ionisierende Strahlung, die p53-p21 aktivieren und Seno-Differenzierung auslösen; und karzinogene Expositionen wie UVB und DMBA, die wachstumsunterstützende Nischenfaktoren aktivieren und die Differenzierungs-„Notbremse" blockieren. Diese Unterscheidung ist wichtig, um zu verstehen, welcher Typ Umwelteinflüsse eher zu Alterungssignalen und welcher eher zu Tumorförderung führt.
Zu den Schlüsselmolekülen, die hervorgehoben wurden, gehören p53 und p21 (als Damage-Sensoren und Zellzyklus-Regulatoren), SCF (Stem Cell Factor) und KIT-Signalisierung (nischenabgeleitete Überlebens‑ und Proliferationshinweise) sowie Veränderungen im Arachidonsäurestoffwechsel, die offenbar mit tumorfördernder Entzündung verknüpft sind. Diese Signalwege verbinden die molekulare Antwort auf genotoxische Ereignisse mit beobachtbaren Phänotypen: Ergrauen versus Melanom‑Entwicklung. Solche molekularen Knotenpunkte bieten Ansatzpunkte für weitere Forschung zur Prävention und Therapie.
Folgerungen für Prävention und Therapie
Das Verständnis der Signale, die McSCs entweder in Richtung Erschöpfung oder Expansion lenken, eröffnet mögliche Interventionsstrategien. Könnte eine Modulation der SCF/KIT-Signalisierung oder des entzündlichen Milieus beschädigte Stammzellen in Richtung sicherer Eliminierung lenken? Bestehen Biomarker, die mit Nischenaktivität assoziiert sind und die Haut identifizieren helfen, die ein erhöhtes Melanomrisiko aufweist, noch bevor Tumore sichtbar werden?
Die translationalen Perspektiven sind derzeit spekulativ, doch der konzeptuelle Fortschritt ist eindeutig: Gewebealterung und Krebs sind keine unabhängig voneinander ablaufenden Phänomene, sondern können unterschiedliche Konsequenzen desselben zellulären Umgangs mit genotoxischem Stress sein. Daraus ergeben sich klinische Fragestellungen zu Screening‑Strategien, frühzeitigen Warnzeichen und möglicherweise Nischen‑gerichteten Präventionsmaßnahmen gegen Melanom.
Expertinnen‑ und Experteneinschätzung
Dr. Maya Reynolds, Dermatologin und Stammzellforscherin (fiktiv), fasst den praktischen Aspekt der Studie zusammen: „Diese Arbeit verbindet sichtbares Altern — wie das Ergrauen — mit tiefgreifenden molekularen Entscheidungspunkten in Stammzellen. Wenn wir lernen, diese Entscheidungen in menschlicher Haut zu lesen, könnten wir neue Frühwarnmarker für das Melanomrisiko gewinnen sowie präventive Strategien entwickeln, die auf die Stammzellnische statt auf den Tumor selbst abzielen.“
Weitere Forschung wird erforderlich sein, um diese Signalwege in menschlichem Gewebe zu validieren, zu kartieren, wie lebenslange Expositionen das Schicksal von McSCs beeinflussen, und zu untersuchen, ob eine Manipulation der Nischen‑Signale die Melanom-Inzidenz senken kann, ohne die normale Gewebeerhaltung zu beeinträchtigen. Solche Studien sollten auch epidemiologische Daten einbeziehen, um mögliche Zusammenhänge zwischen vorzeitigem Ergrauen, Umweltexpositionen und Melanomrisiko beim Menschen zu prüfen.
Quelle: sciencealert


Kommentar hinterlassen