8 Minuten
Ein kompakter, kostengünstiger chemischer Wirkstoff zeigte in einem experimentellen Rattenmodell der Alzheimer-Krankheit bemerkenswerte Effekte: Er kehrte Gedächtnisdefizite um und reduzierte entzündliche Reaktionen im Gehirn. Die Entdeckung richtet den Blick auf einen überraschenden Verursacher: überschüssiges Kupfer, das in Beta-Amyloid-Plaques gebunden ist. Die Wissenschaftlerinnen und Wissenschaftler hinter der Studie geben an, dass das Molekül in präklinischen Tests als unbedenklich bewertet wurde und möglicherweise in Studien am Menschen geprüft werden kann – ein Grund für vorsichtigen Optimismus in Bezug auf eine neue therapeutische Richtung.
Künstlerische Darstellung von Amyloid-Plaques (orange), die sich an Neuronen (blau) anlagern
Warum Kupfer in der Alzheimer-Forschung wichtig ist
Die Alzheimer-Krankheit wird häufig mit Ablagerungen von Beta-Amyloid-Proteinen im Gehirn in Verbindung gebracht. Ob diese Plaques die Ursache für kognitive Einschränkungen sind oder Folge anderer pathologischer Prozesse bleibt wissenschaftlich umstritten, doch als pharmakologisches Ziel bleiben sie von hoher Relevanz. In den letzten zehn Jahren ist ein biochemischer Aspekt zunehmend in den Vordergrund gerückt: die Dysregulation von Metallionen, insbesondere von Kupfer. Dieses Forschungsfeld verknüpft Neurochemie, Metallobiologie und neurodegenerative Pathomechanismen und liefert neue Ansatzpunkte für potenzielle Therapien.
Kupfer ist ein essentielles Spurenelement, das für zahlreiche enzymatische Reaktionen und somit für die normale Funktion des Gehirns erforderlich ist. Kommt es jedoch zu einer Störung der Kupfer-Homöostase — sei es durch genetische Varianten, veränderte Kupfertransportproteine oder Alterungsprozesse —, kann das Metall sich lokal an Beta-Amyloid-Ablagerungen anreichern. Überschüssiges Kupfer fördert zum einen die Aggregation von Amyloid-Proteinen und kann zum anderen reaktive Sauerstoffspezies erzeugen. Dieser oxidative Stress schädigt Lipide, Proteine und DNA, trägt zum Verlust von Neuronen bei und wird mit dem fortschreitenden kognitiven Abbau bei Alzheimer in Verbindung gebracht. Ein besseres Verständnis der Rolle von Kupfer in der Neurodegeneration ist daher zentral für gezielte Behandlungsansätze.
Vom Computerbildschirm zum Ratten-Labyrinth: Wie das Team Verbindungen testete
Forscherinnen und Forscher der Federal University of the ABC (UFABC) in Brasilien führten ein systematisches Screening von neun Kandidatenmolekülen durch, die darauf ausgelegt waren, überschüssiges Kupfer an Beta-Amyloid zu binden und zu entfernen — ein Prozess, der als Kupferchelation bezeichnet wird. Acht der Verbindungen waren Iminverbindungen (organische Moleküle mit einer Kohlenstoff-Stickstoff-Doppelbindung), eine basierte auf dem Quinolin-Gerüst. Zunächst wurden in silico-Modelle und molekulare Simulationen genutzt, um Eigenschaften wie Bindungsaffinität, Selektivität gegenüber Kupferionen und voraussichtliche Fähigkeit zur Überwindung der Blut-Hirn-Schranke zu bewerten. Daraus identifizierten die Autoren drei vielversprechende Kandidaten, bezeichnet als L09, L10 und L11, die theoretisch die für Hirnwirkung erforderliche Penetration der Blut-Hirn-Schranke besitzen könnten.
Im nächsten Schritt folgten in vitro-Zytotoxizitätstests. Kultivierte Maus-Neuronen wurden den drei ausgewählten Verbindungen für 24 Stunden ausgesetzt, um akute Toxizität, Auswirkungen auf oxidativen Stress und Zellintegrität zu prüfen. Kandidat L11 erhöhte dabei den oxidativen Stress und führte zu klaren Schäden an den Zellen, womit er faktisch aus dem weiteren Entwicklungsprozess fiel. Die beiden Iminverbindungen L09 und L10 zeigten dagegen eine geringe Toxizität, schützten Lipidmembranen und DNA vor oxidativem Schaden und wurden somit als geeignetere Kandidaten für Tierversuche eingestuft. Diese stufenweise Präselektion — von Computermodellen über Zellkulturen bis hin zu Tiermodellen — ist charakteristisch für translational orientierte präklinische Forschung und reduziert das Risiko kostspieliger Fehlschläge in späteren Stadien.
Die Gruppe setzte anschließend ein etabliertes Rattenmodell der Alzheimer-Krankheit ein. In diesem Modell wird durch intrazerebrale Injektion von Streptozotocin die Insulinsignalisierung im Gehirn gestört, ein Zustand, der Amyloid-Akkumulation und kognitive Beeinträchtigungen fördert. Solche Modelle zielen nicht auf die exakte Nachbildung aller Aspekte menschlicher Alzheimer-Pathologie, sondern liefern reproduzierbare Endpunkte für Erprobung von Therapeutika: Kupferkonzentrationen in Hirnarealen, Marker neuroinflammatorischer Prozesse, Indikatoren für oxidativen Stress sowie funktionelle Tests wie räumliche Merkfähigkeit in Labyrinthaufgaben. Die behandelten Tiere wurden systematisch auf diese Parameter hin untersucht, um pharmakologische Effekte von L09, L10 und L11 vergleichbar zu machen.
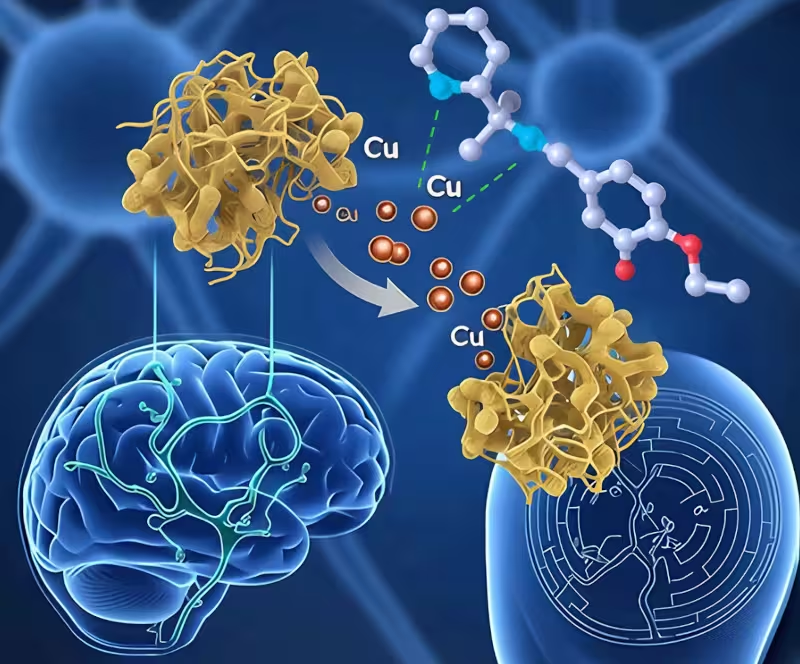
Die neue Verbindung kann Beta-Amyloid-Ablagerungen von überschüssigem Kupfer befreien
Wichtigste Entdeckung: L10 stellt Kupfergleichgewicht und Gedächtnis wieder her
Unter den drei Kandidaten zeigte sich L10 als der deutlich erfolgversprechendste Wirkstoff. Ratten, die mit L10 behandelt wurden, wiesen normalisierte Kupferkonzentrationen im Hippocampus auf — jenem Hirnareal, das intensiv mit Kurz- und Langzeitgedächtnisprozessen verknüpft ist. Parallel dazu sanken Marker für Neuroinflammation und oxidativen Zellstress signifikant, und die Leistung in räumlichen Gedächtnistests, etwa beim Durchlaufen von Labyrinthen, verbesserte sich deutlich im Vergleich zu unbehandelten Kontrolltieren. Diese Resultate deuten darauf hin, dass L10 nicht nur biochemische Pfade moduliert, sondern auch funktionelle kognitive Vorteile liefern kann.
Der Kandidat L09 zeigte in denselben Messgrößen schwächere Effekte, während L11 weiterhin in zellulären Assays schädlich blieb. Aufgrund dieser Vergleichsdaten identifizierten die Autoren L10 als besten Kandidaten für weitere präklinische Entwicklung und mögliche klinische Prüfung. Entscheidend für die Translation in menschliche Studien sind neben der Wirksamkeit auch pharmakokinetische Eigenschaften, Metabolismus, Langzeitsicherheit und die Reproduzierbarkeit der Ergebnisse in weiteren Tiermodellen.
Die Leiterin der Studie, Giselle Cerchiaro (UFABC), hob die praktischen Vorteile des Moleküls hervor: L10 ist chemisch einfach aufgebaut und vergleichsweise günstig in der Herstellung gegenüber vielen aktuellen experimentellen Arzneimitteln. Diese Kosteneffizienz könnte ein wichtiger Faktor sein, falls sich das Präparat in klinischen Prüfungen als wirksam erweist — zumal Alzheimer eine weltweite Gesundheitskrise darstellt, von der schätzungsweise 55 Millionen Menschen betroffen sind. Erschwingliche Therapien würden die Zugänglichkeit verbessern und die Versorgung in unterschiedlichen Gesundheitssystemen erleichtern.
Welche Bedeutung hat das für die Behandlungsstrategie bei Alzheimer?
Die bislang zugelassenen Therapien gegen Alzheimer liefern vorwiegend symptomatische Linderung, greifen aber selten direkt in die zugrunde liegenden pathobiologischen Mechanismen ein oder kehren diese um. Ein therapeutischer Ansatz, der die Metallhomöostase im Gehirn wiederherstellt — durch Reduktion kupfergetriebener Plaque-Aggregation und Verringerung oxidativer Schäden —, verfolgt eine andere, mechanistisch fundierte Strategie. Aus klinischer Sicht ist wichtig, dass solche Maßnahmen vermutlich nicht universell für alle Alzheimer-Patienten geeignet sind, sondern eher für Subgruppen mit nachgewiesener Kupferdysregulation. Dies unterstreicht die biologische Heterogenität der Krankheit und die Notwendigkeit biomarkerbasierter Patientenselektion in künftigen Studien. Eine personalisierte Medizin, die Patientinnen und Patienten nach molekularen Profilen behandelt, könnte die Erfolgswahrscheinlichkeit neuer Wirkstoffe erhöhen.
Expertise und kritische Bewertung
"Das Anvisieren der Metallhomöostase ist eine pragmatische und mechanistisch begründete Strategie", sagt Dr. Anna Morales, Neurologin und translational tätige Forscherin, die nicht an der Studie beteiligt war. "Diese Arbeit ist ermutigend, weil sie eine klare biochemische Hypothese mit gestuften präklinischen Tests verbindet — von molekularem Modeling über Zellkulturassays bis hin zu Verhaltensanalysen in Tiermodellen. Die nächsten großen Herausforderungen werden die Sicherheit und Wirksamkeit beim Menschen sein sowie die Frage, ob das Präparat den richtigen Patientengruppen zugutekommt." Expertinnen wie Dr. Morales betonen zudem, dass reproduzierbare Ergebnisse in mehreren Modellen, Daten zur Pharmakokinetik und umfassende Toxizitätsprofile Voraussetzung für eine verantwortungsvolle klinische Weiterentwicklung sind.
Nächste Schritte und klinische Perspektiven
Die Forscher planen, L10 in klinische Studien zu überführen, um Sicherheit, Verträglichkeit und mögliche kognitive Vorteile beim Menschen zu untersuchen. Zahlreiche offene Fragen bleiben: Wie gut wird die Verbindung in heterogenen Patientenkohorten wirken? Lässt sich L10 mit bestehenden Therapien kombinieren, etwa mit Antikörpern gegen Beta-Amyloid oder mit Medikamenten, die synaptische Funktion unterstützen? Sind die beobachteten kognitiven Verbesserungen langlebig, oder sind wiederholte Behandlungen notwendig? Um diese Fragen zu beantworten, sind sorgfältig konzipierte Studien erforderlich, die Biomarker für Kupferungleichgewicht und Amyloid-Pathologie nutzen, um geeignete Teilnehmerinnen und Teilnehmer zu identifizieren und die Wirkung präzise zu messen.
Zum jetzigen Zeitpunkt steht L10 als ein vielversprechender, preiswerter Kandidat, der die Forschung auf die Metallchemie im Gehirn lenkt — ein Bereich, der gezielte Therapien für eine Untergruppe von Alzheimer-Patientinnen und -Patienten hervorbringen könnte. Wie bei allen positiven präklinischen Befunden gilt jedoch: Ergebnisse aus Tiermodellen müssen in randomisierten, kontrollierten Studien am Menschen bestätigt werden, bevor ein Medikament klinisch eingesetzt werden kann. Die Studie liefert jedoch eine klare Vorgehensweise, wie molekulare Einsichten in eine potenziell therapeutische Option überführt werden können, und sie erweitert die Palette an Konzepten zur Behandlung neurodegenerativer Erkrankungen.
Quelle: sciencealert

Kommentar hinterlassen