12 Minuten
Japanische Wissenschaftler haben neuartige Vitamin‑K‑Moleküle der nächsten Generation entwickelt, die die Fähigkeit des Gehirns, neue Neurone zu bilden, deutlich steigern. Durch die chemische Verbindung von Vitamin K mit Retinsäure (dem aktiven Metaboliten von Vitamin A) erzeugten die Forscher hybride Verbindungen, die die neuronale Differenzierung weitaus effektiver auslösen als natürlich vorkommendes Vitamin K — ein Ergebnis mit potenziellen Implikationen für Therapien gegen Alzheimer und verwandte neurodegenerative Erkrankungen. Diese Studie verknüpft Nährstoffbiologie mit gezielter Wirkstoffentwicklung und liefert damit neue Ansatzpunkte für Neuroregeneration, Blut‑Hirn‑Schrankenpassage und pharmakologische Optimierung.
Why neuronal regeneration matters now
Neurodegenerative Erkrankungen wie Alzheimer, Parkinson und Huntington führen schrittweise zum Verlust von Neuronen — den informationsverarbeitenden Zellen des Gehirns. Wenn Neurone absterben oder ihre Funktion verlieren, resultieren daraus Gedächtniseinschränkungen, motorische Defizite und ein fortschreitender kognitiver Abbau. Die heute verfügbaren Medikamente lindern in erster Linie Symptome; sie kehren den neuronalen Verlust selten um. Genau diese Lücke motiviert die Forschung an regenerativen Strategien: Gelingt es, das Gehirn dazu zu bringen, aus Vorläuferzellen neue Neurone zu differenzieren, könnten beschädigte Schaltkreise repariert, stabilisiert oder funktionell ersetzt werden. Die Begriffe "neuronale Differenzierung" und "Neuroregeneration" gewinnen damit nicht nur in der Grundlagenforschung, sondern auch in translationalen Programmen für Alzheimer‑Therapien an Bedeutung.
Vitamin K, ein fettlösliches Vitamin, das klassisch mit Blutgerinnung und Knochenstoffwechsel assoziiert wird, ist in den letzten Jahren als überraschender Faktor im Gehirn in den Fokus gerückt. Zellkultur‑ und Tierstudien haben gezeigt, dass bestimmte Formen von Vitamin K die Neuronenüberlebensrate verbessern und die neuronale Differenzierung fördern können. Natürliche Varianten wie Menaquinon‑4 (MK‑4) zeigen jedoch nur begrenzte Wirksamkeit und Bioverfügbarkeit für therapeutische Anwendungen. Das weckte die Frage bei Chemikern und Neurowissenschaftlern, ob eine gezielte molekulare Neukonstruktion die neuroaktiven Effekte von Vitamin K verstärken und die Wirkstoffeigenschaften verbessern könnte.
Vor dem Hintergrund dieser Zielsetzung entstanden Forschungsansätze, die biologische Signaturen von Vitaminen mit pharmakologischer Zielgerichtetheit kombinieren. Stichworte in diesem Kontext sind: Blut‑Hirn‑Schranke (blood‑brain barrier), pharmakokinetische Optimierung, receptorselektive Modulation und epigenetische Regulation. Solche Konzepte sind zentral für die Entwicklung von Regenerationsmitteln, die in das zentrale Nervensystem (ZNS) gelangen und dort sowohl Signalwege aktivieren als auch stabile, physiologisch sinnvolle neuronale Netzwerke fördern.
Designing a more potent vitamin K
Ein Team am Shibaura Institute of Technology in Japan verfolgte genau dieses Ziel. Unter der Leitung von Associate Professor Yoshihisa Hirota und Professor Yoshitomo Suhara synthetisierte die Gruppe eine Reihe hybrider Vitamin‑K‑Analoga, indem sie das Vitamin‑K‑Gerüst chemisch mit Retinsäure verband — einem bekannten Induktor neuronaler Differenzierung. Die rationale Designstrategie kombinierte bewährte bioaktive Motive beider Ausgangsmoleküle, mit dem Ziel, additive oder synergistische Effekte zu erzielen.
Insgesamt entwickelten die Forschenden ein Panel von 12 hybriden Homologen. Diese kombinierten Vitamin K entweder mit einer Retinsäure‑Einheit, einer Carbonsäuregruppe oder einer Methylester‑Seitenkette. Wissenschaftlich verfolgte Ziele waren dabei zweifach: Zum einen sollten die biologischen Signaturen beider Parentmoleküle (Vitamin K und Retinsäure) erhalten bleiben; zum anderen sollte geprüft werden, ob die konjugierte Struktur eine stärkere Induktion neuronaler Schicksale in neuralen Progenitorzellen hervorruft. Die Variation der Seitenketten diente zudem der Untersuchung von Struktur‑Wirkungs‑Beziehungen hinsichtlich Aufnahme, Metabolisierung und Rezeptorbindung.
In Kulturen muriner neuraler Progenitoren prüfte das Team die transkriptionelle Aktivierung zweier nukleärer Rezeptoren: den Steroid‑ und Xenobiotika‑Rezeptor (SXR), der durch Vitamin K beeinflusst werden kann, sowie den Retinsäurerezeptor (RAR), der durch Retinsäure aktiviert wird. Wichtig war die Frage, ob die Hybridmoleküle an beiden funktionellen Zielorten aktiv bleiben. Die Ergebnisse zeigten, dass die konjugierten Verbindungen in beiden Rezeptorsystemen aktiv waren, was darauf hindeutet, dass die jeweiligen funktionellen Einheiten ihre biologische Kompetenz auch nach der Konjugation bewahren.
Methodisch kombinierten die Forscher Biochemie, In‑vitro‑Assays zur Differenzierung von Progenitorzellen, Receptor‑Reporter‑Assays und molekulare Modellierung. Diese interdisziplinäre Herangehensweise erlaubt nicht nur die Identifikation eines Wirkstoffkandidaten, sondern auch die Erschließung molekularer Mechanismen hinter beobachteten Effekten — ein wichtiger Schritt hin zu translationaler Relevanz.
Novel VK: a standout candidate
Von den synthetisierten Verbindungen stach ein Hybrid besonders hervor: in der Studie als "Novel vitamin K analogue" (Novel VK) bezeichnet. Diese Verbindung kombinierte die Retinsäure‑Konjugation mit einer Methylester‑Seitenkette und zeigte eine außergewöhnlich hohe Potenz. Novel VK steigerte die neuronale Differenzierung in den getesteten Systemen um etwa das Dreifache im Vergleich zum nativen Vitamin‑K‑Kontrollpräparat. Die Messung der neuronalen Konversion erfolgte unter anderem durch die Verfolgung von Microtubule‑associated protein 2 (Map2), einem etablierten Marker reifer Neurone.
Ein solcher Aktivitätszuwachs ist mehr als ein laborbiologischer Befund: Ein Molekül, das zuverlässig neuronale Vorläufer in Neurone umschaltet, kann als regenerativer Wirkstoffkandidat dienen, der dazu geeignet ist, Zellen zu ersetzen, die infolge neurodegenerativer Prozesse verloren gegangen sind. Zugleich sind Fragen nach Spezifität, Dosisantwort und möglichen Nebeneffekten zu prüfen, um klinische Anwendbarkeit zu beurteilen.
Die Beobachtungen legen nahe, dass gezielte chemische Modifikationen die neuroaktive Potenz von Vitaminen erhöhen können. Solche Vitamin‑Derivate könnten in Zukunft als Leitstrukturen für die Entwicklung von Medikamenten gegen neurodegenerative Erkrankungen dienen, sofern sie in präklinischen und klinischen Studien Sicherheit und Wirksamkeit belegen.
Peering into the mechanism: mGluR1 and epigenetic cues
Die Untersuchung der Wirkmechanismen war zentraler Bestandteil der Arbeit. Vergleichende Genexpressionsanalysen zwischen MK‑4‑behandelten Zellen und Zellen, die zusätzlich mit spezifischen Inhibitoren behandelt wurden, identifizierten einen unerwarteten molekularen Partner: metabotrope Glutamatrezeptoren (mGluRs). Insbesondere mGluR1 tauchte als Schlüsselfaktor auf, der vitamin‑K‑vermittelte Genregulation und epigenetische Veränderungen beeinflusst, die für die Entscheidung von Zellen zugunsten eines neuronalen Schicksals relevant sind.
mGluR1 ist ein an der Zelloberfläche lokalisierteter Rezeptor, der synaptische Signale moduliert und intrazelluläre Signalwege aktiviert. Vorgängerstudien an Tieren zeigen, dass der Verlust von mGluR1 zu Störungen der motorischen Kontrolle und neuronalen Kommunikation führt — Phänotypen, die für neurodegenerative Erkrankungen relevant sind. Die Gruppe am Shibaura Institute nutzte computergestützte Strukturmodellierung und molekulares Docking, um zu testen, ob die neuartigen Vitamin‑K‑Analoga direkt mit mGluR1 interagieren. Die Simulationen stützten eine starke Bindung zwischen Novel VK und mGluR1, konsistent mit den ausgeprägten biologischen Effekten in den Zellassays.
Diese Mechanistik vereint mehrere Ebenen: Rezeptorinteraktion (mGluR1), nukleäre Transkriptionsmodulation (SXR, RAR), und epigenetische Umbauten, die zusammen neuronale Schicksalsentscheidungen fördern können. Die Identifikation von mGluR1 als möglichem mediator erweitert die Zielpalette jenseits klassischer nukleärer Rezeptoren und eröffnet Perspektiven zur Kombination receptoraler und epigenetischer Therapiestrategien.
Cellular uptake and conversion to active MK-4
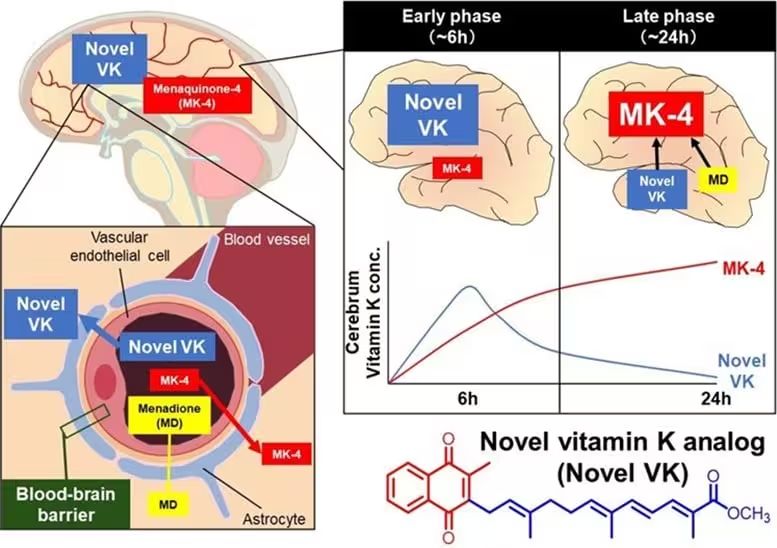
Ein weiterer bedeutsamer Befund war die Effizienz, mit der Novel VK in Zellen aufgenommen und dort in MK‑4, die aktive intrazelluläre Form, umgewandelt wurde. In Zellkulturen sowie in Mausmodellen stiegen intrazelluläre MK‑4‑Konzentrationen proportional zur Exposition gegenüber Novel VK. Verglichen mit Standard‑Vitamin‑K‑Präparaten gelang die Konversion zu MK‑4 schneller und in größerem Umfang, wodurch höhere Hirnkonzentrationen erreicht wurden. Besonders wichtig war die Beobachtung, dass Novel VK die Blut‑Hirn‑Schranke überwinden konnte und ein günstiges pharmakokinetisches Profil zeigte — essentielle Eigenschaften für jede Substanz, die im zentralen Nervensystem wirken soll.
Diese verbesserte Bioverfügbarkeit und die effiziente intrazelluläre Umwandlung stützen die These, dass chemische Umgestaltung nicht nur die Wirksamkeit, sondern auch die pharmakologische Verteilungscharakteristik von Nährstoffderivaten verbessern kann. Für die Translation in klinische Anwendungen sind solche pharmakokinetischen Daten von grundlegender Bedeutung, da sie Aufschluss über Dosierung, Verteilung im Gewebe und mögliche metabolische Umwege geben.
Die Forschenden bestätigten, dass Novel VK im Gehirn höhere MK‑4‑Spiegel erzeugte als konventionelle Vitamin‑K‑Formulierungen, was den Fall stützt, dass chemische Neukonstruktion sowohl Potenz als auch Bioverfügbarkeit verbessert.
Translational implications: toward vitamin K–based therapies
Diese Ergebnisse zeigen einen konkreten Pfad von der Nährstoffbiologie hin zu potenziellen Therapeutika. Durch die Kartierung der beteiligten Rezeptoren und molekularen Signalwege liefert die Studie sowohl eine Leitverbindung (Novel VK) als auch eine mechanistische Begründung für weiterführende Entwicklungsschritte. Sollten nachfolgende präklinische und klinische Untersuchungen Sicherheit und Wirksamkeit bestätigen, könnten Vitamin‑K‑abgeleitete Wirkstoffe eine neue Klasse regenerativer Therapien bilden, die darauf abzielen, neuronalen Verlust bei Alzheimer und anderen neurodegenerativen Erkrankungen zu verlangsamen oder teilweise rückgängig zu machen.
Praktische Hürden bleiben jedoch bestehen. Jeder Kandidat muss strenge Toxizitätsprüfungen durchlaufen, eine Dosisoptimierung erfahren und einen nachweisbaren Langzeutnutzen in Tiermodellen zeigen, die die Pathologie menschlicher Erkrankungen adäquat widerspiegeln. Das Studiendesign in klinischen Prüfungen muss zudem den zeitlichen Aspekt berücksichtigen: Regenerative Strategien könnten am wirkungsvollsten in frühen oder mittleren Krankheitsstadien sein, wenn noch genügend Vorläuferzellen vorhanden sind und überlebende Schaltkreise auf Differenzierungsreize reagieren können.
Dr. Yoshihisa Hirota und Kollegen betonen den breiteren Wert des Ansatzes: „Unsere Analoga zeigen, dass moderate chemische Veränderungen das neurogene Potenzial von Vitamin K dramatisch erhöhen können. Das eröffnet neue Wege für Therapeutika, die die Sicherheitsprofile von Vitaminen mit gezielter molekularer Aktivität kombinieren“, so die Forschenden. Diese Perspektive verbindet bekannte Sicherheitsaspekte von Mikronährstoffen mit modernen Prinzipien der Wirkstoffdesigns, was insbesondere für Patientengruppen mit chronischen Erkrankungen von Interesse ist.
Die Forscher vom Shibaura Institute of Technology haben neuartige Vitamin‑K‑Analoga entworfen und synthetisiert, die mit Retinsäure kovalent verbunden sind und potente Aktivitäten zur Induktion neuronaler Differenzierung zeigen. Ihre Ergebnisse heben einzigartige Mechanismen hervor, die den neuroprotektiven Effekten von Vitamin K und seinen Analoga zugrunde liegen, und ebnen den Weg für die Entwicklung wirksamer Behandlungen gegen neurodegenerative Erkrankungen. Credit: Associate Professor Yoshihisa Hirota, Shibaura Institute of Technology, Japan
What this means for patients and the research pipeline
Für Patientinnen und Patienten sowie deren pflegende Angehörige, die mit Alzheimer und verwandten Störungen konfrontiert sind, bedeutet diese Forschung Hoffnung, aber noch keinen unmittelbaren Durchbruch. Die wichtigste kurzfristige Wirkung wird voraussichtlich die präklinische Forschung sein: Die Verfügbarkeit eines potenten, das Gehirn durchdringenden Vitamin‑K‑Analogons stellt Laboren ein neues Werkzeug zur Verfügung, mit dem neuronale Regeneration, synaptische Reparatur und krankheitsspezifische Modelle intensiver untersucht werden können. Solche Werkzeuge tragen dazu bei, Zielmechanismen zu validieren und Biomarker für nachfolgende klinische Studien zu identifizieren.
Auf bevölkerungsbezogener Ebene könnte eine effektive regenerative Therapie langfristig Pflegebedarfe und Gesundheitskosten reduzieren, die mit fortschreitender Demenz verbunden sind. Die Umsetzung von Laborbefunden in sichere, wirksame Behandlungen für Menschen erfordert jedoch Jahre umfangreicher Tests, strenger regulatorischer Prüfungen und gestufter klinischer Studien.

Cover image featuring the study about novel vitamin K analogues conjugated with retinoic acid, exhibiting neuroprotective effects. Credit: ACS Chemical Neuroscience
Expert Insight
„Diese Studie schlägt eine elegante Brücke zwischen Small‑Molecule‑Chemie und neuronaler Biologie“, erklärt Dr. Eleanor Park, eine fiktive Neuropharmakologin und Wissenschaftskommunikatorin. „Zwei Aspekte stechen heraus: das rationale Design, Vitamin‑K‑ und Retinsäure‑Motifs zu kombinieren, und die mechanistische Verbindung zu mGluR1. Zusammen erzählen sie eine konsistente Geschichte vom Molekül zum Mechanismus. Die nächsten kritischen Schritte werden darin bestehen, Langzeiteffekte in krankheitsrelevanten Tiermodellen zu validieren und die Sicherheit bei therapeutischen Dosen zu gewährleisten.“
Dr. Park ergänzt: „Es ist selten, dass nährstoffabgeleitete Verbindungen sowohl die Blut‑Hirn‑Schranke überwinden als auch Differenzierungswege so robust modulieren. Wenn diese Eigenschaften außerhalb der initialen Studie bestätigt werden, könnte das unseren Ansatz zur Neuroregeneration nachhaltig verändern.“
Looking ahead: research priorities and future prospects
- Erweitern Sie die präklinischen Tests in Alzheimer‑ und Parkinson‑Tiermodellen, um kognitive und motorische Endpunkte nach Behandlung mit Novel VK zu bewerten.
- Untersuchen Sie langfristige Sicherheit, mögliche Off‑Target‑Effekte und Pharmakodynamik über Altersgruppen und Krankheitsstadien hinweg.
- Verfeinern Sie die Verbindungschchemie zur Optimierung der Hirnverteilung, metabolischen Stabilität und Rezeptorselektivität.
- Entwerfen Sie frühphasige klinische Studien mit Fokus auf Sicherheit, Biomarker neuronaler Regeneration und funktionelle Endpunkte in sorgfältig ausgewählten Patientengruppen.
Kurz gesagt liefert die Studie des Shibaura Institute of Technology einen überzeugenden Proof‑of‑Concept: Chemisch optimierte Vitamin‑K‑Analoga können potente Auslöser neuronaler Differenzierung sein, mit relevanten neuronalen Rezeptoren wie mGluR1 interagieren, die Blut‑Hirn‑Schranke passieren und die aktive Form MK‑4 im Gehirn erhöhen. Diese Eigenschaften bilden die notwendigen Voraussetzungen für einen vielversprechenden therapeutischen Lead — allerdings einen, der noch Jahre rigoroser Validierung benötigt, bevor er in klinischen Anwendungen ankommen kann.
Quelle: scitechdaily


Kommentar hinterlassen