10 Minuten
Für unsere Ohren unsichtbar, in der Klinik jedoch wirkungsvoll: Fokussierter Ultraschall entwickelt sich zunehmend zu einer nichtinvasiven Methode zur Behandlung von Hirnerkrankungen und Krebs. Aktuelle Fortschritte erlauben es Klinikerinnen und Klinikern, konzentrierte Schallenergie auf winzige Gewebsvolumen zu richten, um Barrieren zu öffnen, Medikamente zu transportieren, Immunantworten zu stimulieren und in manchen Fällen krankhaftes Gewebe zu zerstören — ganz ohne Skalpell oder ionisierende Strahlung. Diese Vielseitigkeit macht den fokussierten Ultraschall zu einer vielseitigen Plattformtechnologie in der neurochirurgischen und onkologischen Forschung.
How focused ultrasound harnesses inaudible sound
Ultraschall nutzt Schallwellen oberhalb des menschlichen Hörbereichs, um medizinische Bilder zu erzeugen und zunehmend auch Erkrankungen zu behandeln. Ein Schallwandler (Transducer) wandelt elektrische Signale in mechanische Schwingungen um; diese Wellen durchdringen den Körper, werden an Gewebegrenzen reflektiert und kehren als Echo zurück, das von Computern zu Bildern rekonstruiert wird. Werden dieselben Wellen jedoch auf einen kleinen Zielpunkt fokussiert — häufig ein Volumen nicht größer als ein Reiskorn — verändern sich ihre mechanischen und thermischen Effekte grundlegend. Fokussierter Ultraschall kann Gewebe erwärmen, Druck auf Gefäßwände ausüben oder winzige Gasblasen im Blut zum Schwingen bringen. Diese Effekte eröffnen eine Bandbreite therapeutischer Strategien, von thermischer Ablation bis zu mechanischer Modulation von Zellfunktionen.
MRT-geführte fokussierte Ultraschallsysteme (MRI-guided focused ultrasound) fügen eine zweite Kontrollebene hinzu. Die Bildgebung ermöglicht es Behandlern, das Ziel in Echtzeit zu visualisieren, Temperaturänderungen zu überwachen und Dutzende bis Tausende kleiner Schallbündel gezielt so zu steuern, dass sie präzise konvergieren. Erste Experimente vor mehr als acht Jahrzehnten zeigten, dass konzentrierter Ultraschall Hirngewebe ablieren kann — ähnlich wie das Fokussieren von Sonnenlicht mit einer Lupe — doch erst jahrzehntelange Verbesserungen in der Bildgebung, in Transducer‑Arrays und in akustischen Modellen machten den sicheren und zuverlässigen Einsatz im Gehirn möglich. Technische Fortschritte bei Beamsteering, Phased-Array-Transducern und akustischer Modellierung haben die Genauigkeit weiter erhöht und die Anwendungssicherheit verbessert.
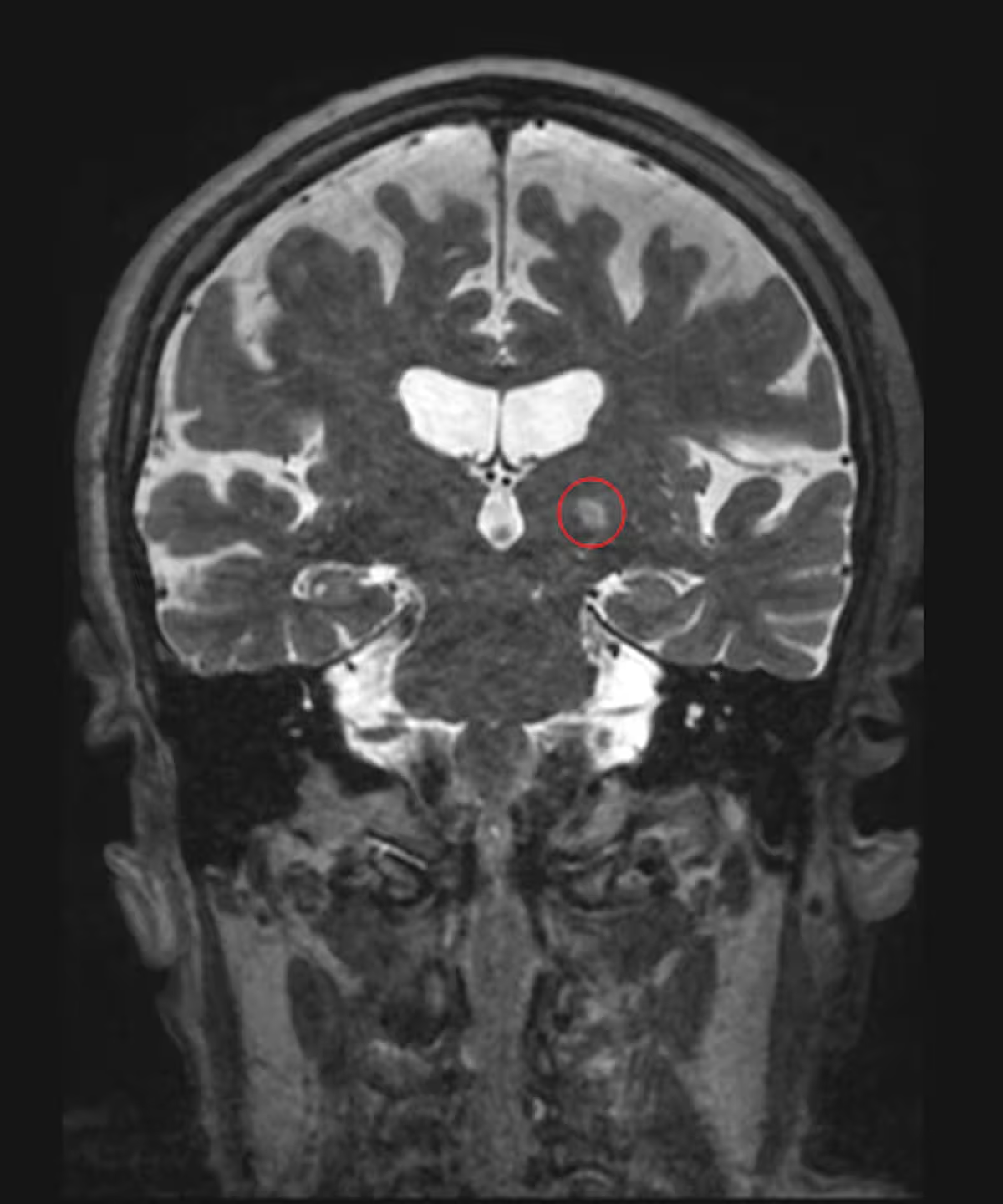
MRT-Aufnahme eines Patienten, der wegen essenziellem Tremor mit fokussiertem Ultraschall behandelt wurde; der gezielte Bereich des Gehirns ist rot umkreist. (Jmarchn/Wikimedia Commons, CC BY-SA)
Opening the blood-brain barrier — a targeted door for medicines
Die Blut-Hirn-Schranke (BHS, engl. Blood-Brain Barrier, BBB) ist eine streng regulierte Zellschicht, die das Gehirn schützt, indem sie kontrolliert, welche Substanzen aus der Blutbahn ins neuronale Gewebe gelangen. Diese Schutzfunktion verhindert jedoch auch, dass viele Medikamente, große Moleküle und Gentherapeutika erkrankte Bereiche erreichen. Fokussierter Ultraschall bietet hier eine selektive Lösung: Niedrigintensive Impulse, die auf einen definierten Punkt gerichtet werden, lassen bereits im Blut vorhandene Mikrobubbles (Mikroblasen) schwingen. Durch diese Schwingung lockern sich vorübergehend die Tight Junctions an der Gefäßwand, es entstehen nanoskalige Poren, und therapeutische Wirkstoffe können genau dort in das Gehirn diffundieren — nur in dem Bereich, in dem der Ultraschall appliziert wurde.
Diese gezielte BBB-Öffnung wurde in Tiermodellen und in frühen Humanstudien bestätigt. Forschende haben fokussierten Ultraschall eingesetzt, um die Chemotherapiezufuhr bei Glioblastomen und Hirnmetastasen zu verbessern und die Konzentration experimenteller Alzheimer‑Medikamente in betroffenen Hirnregionen zu erhöhen. Parallele Studien zeigen Potenzial für die Abgabe viraler Vektoren und anderer Gentherapie‑Träger, die normalerweise die Blut-Hirn-Schranke nicht passieren — wodurch genetische Therapien gegen neurodegenerative und entwicklungsbedingte Hirnerkrankungen realistischer werden. Weiterhin werden Parameter wie Pulsdauer, Druckamplitude und Mikroblasenformulierung optimiert, um eine transient kontrollierte Permeabilität ohne entzündliche Nebenwirkungen zu erreichen.
Why this matters
- Präzision: Nur die vom Ultraschall anvisierte Zone wird permeabel, wodurch systemische Nebenwirkungen reduziert werden können.
- Wiederholbarkeit: Der Eingriff lässt sich mehrfach durchführen, was gestaffelte Dosierungen oder Booster‑Behandlungen ermöglicht.
- Kompatibilität: Fokussierter Ultraschall kann vorhandene Medikamente und Therapien ergänzen, statt sie zu ersetzen, und ist mit etablierten Bildgebungsverfahren kombinierbar.
Wakening the immune system: ultrasound plus immunotherapy
Viele solide Tumoren gelten als immunologisch „kalt“: Sie ziehen keine effektive Immunantwort an und zeigen nur wenige erkennbare Signale, die eine Attacke des Immunsystems auslösen würden. Fokussierter Ultraschall kann diese Immun‑Kälte verändern. Durch mechanische Disruption eines Tumors oder kontrollierte Erhitzung zerkleinert Ultraschall Tumorzellen zu Fragmenten und setzt Tumorantigene frei. Diese Fragmente können zu Lymphknoten gelangen, wo Antigen-präsenterende Zellen Immunzellen schulen, das Maligne als Ziel zu erkennen und anzugreifen. Dadurch wird die lokale Tumorumgebung immunologisch aufgewärmt und die Ansprechbarkeit auf systemische Immuntherapien verbessert.
Labore und frühe klinische Programme prüfen Kombinationsansätze aus fokussiertem Ultraschall und Checkpoint-Inhibitoren sowie anderen Immuntherapien. Ziel ist es, kalte Tumoren — etwa bestimmte Pankreas-, Brust- und Hirntumoren — in immunologisch „heiße“ Tumoren zu verwandeln, die auf systemische Immuntherapeutika ansprechen. 2022 gründete die University of Virginia ein eigenes Zentrum zur Beschleunigung der Immunonkologie‑Forschung mit fokussiertem Ultraschall, und explorative Studien kombinieren Ultraschall bereits mit Immuntherapien bei fortgeschrittenem Melanom und weiteren Tumorentitäten. Neben klinischen Endpunkten evaluieren Studien immunologische Biomarker, T‑Zell‑Infiltrate und Neoantigen‑Präsentation, um Wirkmechanismen und Best-Practice‑Protokolle zu definieren.
Examples in practice
- Direkte Ablation: Hochintensiver fokussierter Ultraschall (HIFU) kann kleine Tumoren thermisch zerstören, ohne einen Schnitt zu setzen, und ermöglicht so minimalinvasive Behandlungsoptionen.
- Immune priming: Sub‑ablative Ultraschallimpulse können Tumorantigene und inflammatorische Signale freisetzen, um die Immunerkennung zu verbessern.
- Medikamentenabgabe: Ultraschall‑vermittelte Gefäßöffnung optimiert die lokale Verteilung von Chemotherapeutika, monoklonalen Antikörpern oder ADCs (Antibody‑Drug Conjugates).
Beyond common diseases: rare disorders and structural lesions
Während Krebs und Alzheimer viel Aufmerksamkeit auf sich ziehen, besitzt fokussierter Ultraschall auch Potenzial für seltene vaskuläre und strukturelle Hirnerkrankungen. Ein Beispiel ist die zerebrale kavernöse Malformation (CCM), eine Erkrankung, bei der sich abnorm proliferierende Gefäßzellen zu fragilen Läsionen formen, die bluten oder epileptische Anfälle auslösen können. Operative Eingriffe sind oft Standard, doch einige Läsionen liegen tief oder in unmittelbarer Nähe zu sensiblen Hirnregionen, so dass eine Operation mit hohem Risiko verbunden ist.
Präklinische Arbeiten deuten darauf hin, dass fokussierter Ultraschall die Medikamentenverteilung zu CCM‑Herden verbessern und — überraschenderweise — in Tiermodellen sogar das Läsionswachstum stabilisieren kann, selbst ohne gleichzeitige Medikamentengabe. Der zugrunde liegende Mechanismus ist noch nicht vollständig geklärt; mögliche Erklärungen reichen von veränderter Gefäßdynamik über immunmodulatorische Effekte bis zu direkten biomechanischen Einflüssen auf Endothelzellen. Diese Beobachtungen haben Neurochirurginnen und Neurochirurgen dazu veranlasst, Pilot‑Studien zu planen. Sollte sich der Effekt beim Menschen bestätigen, könnte fokussierter Ultraschall eine schonendere Alternative zur offenen Chirurgie für schwer zugängliche Läsionen bieten und das therapeutische Spektrum für seltene neurovaskuläre Erkrankungen erweitern.
Technical hurdles, safety and the path to wider adoption
Fokussierter Ultraschall ist kein Allheilmittel. Form und Dichte des Schädels können Schallwellen verzerren, daher sind individualisierte akustische Modelle und große Multi‑Element‑Transducer‑Arrays erforderlich, um die Krümmung und die akustischen Eigenschaften des Schädels zu kompensieren. Temperaturüberwachung und Echtzeitbildgebung sind essenziell, um die Patientensicherheit zu gewährleisten und unbeabsichtigte Schädigungen zu vermeiden. Zusätzlich erfordern regulatorische Zulassungen krankheitspezifische Studien, die nicht nur Sicherheit, sondern auch einen klinisch relevanten Nutzen gegenüber bestehenden Standardtherapien nachweisen.
Trotz dieser Herausforderungen wurden weltweit Hunderte klinische Studien initiiert, die fokussierten Ultraschall für verschiedene neurologische und onkologische Indikationen prüfen. Essentieller Tremor wird in vielen Zentren bereits routinemäßig mit fokussiertem Ultraschall behandelt; weitere laufende Studien zielen auf Glioblastom, metastatische Hirnerkrankungen, Alzheimer‑Demenz und mehrere seltene ZNS‑Erkrankungen. Wichtige Sicherheitsaspekte umfassen die Kontrolle von Ödembildung, pontinem oder kortikalem Schaden und die Minimierung systemischer Nebenwirkungen durch präzises Targeting. Standardisierte Protokolle für Patientenselektion, intraoperative Überwachung und Nachsorge sind entscheidend für eine breite klinische Implementierung.
Future directions: combining technologies for smarter therapies
Die spannendsten Perspektiven ergeben sich aus der Kombination fokussierten Ultraschalls mit aufkommenden Modalitäten: zielgerichteten Nanopartikeln, Geneditier‑Vektoren und fortgeschrittenen Immuntherapien. Stellen Sie sich vor, CRISPR‑Werkzeuge nur in einen Tumor oder eine betroffene Hirnregion zu bringen, oder Ultraschall zu nutzen, um Nanopartikel so zu steuern, dass sie erst nach Öffnung der Blut‑Hirn‑Schranke Wirkstoffe freisetzen. Solche Hybridansätze versprechen höhere Wirksamkeit bei gleichzeitig geringerer systemischer Toxizität — eine Schlüsselanforderung für personalisierte Medizin.
Ingenieure arbeiten zudem an der Miniaturisierung von Ultraschallsystemen und verbessern die Strahlsteuerung, was ambulante oder tagesklinische Behandlungen ermöglichen und den Zugang über Spezialzentren hinaus erweitern könnte. Mit der Reifung akustischer Modellierung, Bildgebung und Echtzeit‑Feedbacksystemen werden Behandelnde zunehmend feinere Kontrolle darüber erhalten, wo und wie Ultraschall auf zellulärer und molekularer Ebene wirkt. Parallel dazu werden Algorithmen für adaptive Steuerung, KI‑gestützte Zielerkennung und automatisierte Sicherheitsschleifen die Präzision weiter erhöhen.
Expert Insight
„Fokussierter Ultraschall ist ein Werkzeugkasten, keine einzige Therapie“, sagt Dr. Elena Morales, eine Biomedizintechnikerin, die mit klinischen Teams an der Geräteentwicklung zusammenarbeitet. „Seine Stärken sind Präzision und Flexibilität — man kann die Energie so einstellen, dass die Blut‑Hirn‑Schranke geöffnet wird, Gewebe gerade genug erhitzt wird, um Tumorzellen abzutöten, oder mechanische Kräfte erzeugt werden, die das Immunsystem alarmieren. Die Herausforderung besteht nun darin, das Verfahren intelligent mit Medikamenten und Biologika zu integrieren, um reale klinische Probleme zu lösen.“
Ihre Einschätzung spiegelt eine breitere Meinung in der translationellen Forschung wider: Der größte Wert des fokussierten Ultraschalls könnte darin liegen, als Ermöglichungstechnologie andere Therapien effektiver zu machen. Durch die Kombination mit Biomarkern, Bildgebungs-basierten Endpunkten und personalisierten Therapieprotokollen lässt sich das volle Potenzial dieser Technologie besser ausschöpfen.
What patients and clinicians should know now
Für Patientinnen und Patienten, die fokussierten Ultraschall in Betracht ziehen, ist es wichtig zu klären, ob eine Behandlung Teil eines zugelassenen Verfahrens oder einer klinischen Studie ist, welche bekannten Risiken für das konkrete Protokoll bestehen und wie das Behandlungsteam das Monitoring und die Nachsorge organisiert. Wichtige Fragen betreffen auch Alternativen, erwartete Erholungszeiten und mögliche Langzeitfolgen. Für Klinikerinnen und Kliniker erfordert die Integration fokussierten Ultraschalls interdisziplinäre Zusammenarbeit — Neurochirurgie, Radiologie, Onkologie, Ingenieurwesen und Immunologie — um Studien zu entwerfen, die klinischen Nutzen klar und messbar nachweisen.
Fokussierter Ultraschall hat sich in kurzer Zeit von einer experimentellen physikalischen Kuriosität zu einer klinisch relevanten Technologie entwickelt. Die nächsten zehn Jahre werden zeigen, ob das Versprechen — zielgerichtete Medikamenten‑ und Gentherapieabgabe, Immunaktivierung gegen Tumore und schonendere Behandlungsoptionen für seltene Hirnerkrankungen — in belastbare, klinische Resultate für Patientinnen und Patienten mündet. Wichtig sind dabei robuste klinische Daten, Standardisierung von Protokollen und die Weiterentwicklung sicherer, zugänglicher Technologien.
Quelle: sciencealert


Kommentar hinterlassen